af valeria lizzeth peña moreno 4 år siden
585
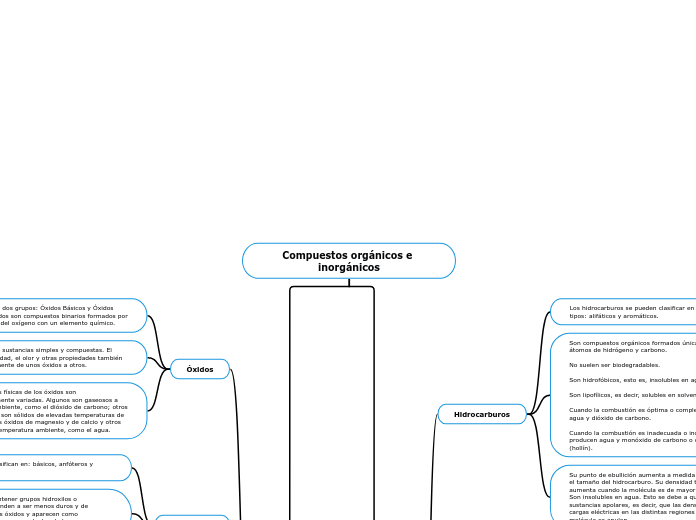
Compuestos orgánicos e inorgánicos
af valeria lizzeth peña moreno 4 år siden
585

Mere som dette