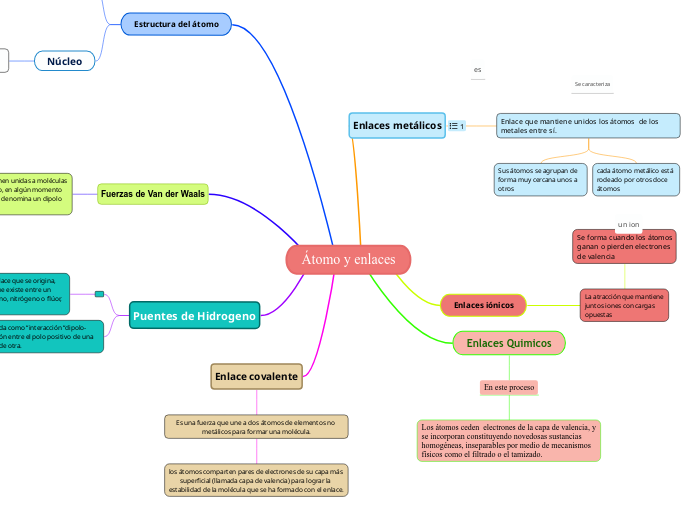
Átomo y enlaces
Enlaces metálicos
Enlace que mantiene unidos los átomos de los metales entre sí.
Sus átomos se agrupan de forma muy cercana unos a otros
cada átomo metálico está rodeado por otros doce átomos
Enlaces iónicos
La atracción que mantiene juntos iones con cargas opuestas
Se forma cuando los átomos ganan o pierden electrones de valencia
Enlaces Quimicos
En este proceso
Los átomos ceden electrones de la capa de valencia, y se incorporan constituyendo novedosas sustancias homogéneas, inseparables por medio de mecanismos físicos como el filtrado o el tamizado.
Estructura del átomo
Corteza
Es la parte exterior del átomo
Electrones
De carga negativa (-)
Núcleo
Es la parte central del átomo y contiene partículas con carga positiva
Neutrones
De carga neutra ( )
Protones
De carga positiva (+)
Fuerzas de Van der Waals
Son atracciones débiles que mantienen unidas a moléculas eléctricamente neutras; sin embargo, en algún momento estas moléculas presentan lo que se denomina un dipolo inducido
Tipos
Fuerzas dipolo-dipolo (también llamadas fuerzas de Keesom).
Fuerzas dipolo-dipolo inducido (también llamadas fuerzas de Debye).
Fuerzas dipolo instantáneo-dipolo inducido (también llamadas fuerzas de dispersión o fuerzas de London).
Puentes de Hidrogeno
Un puente de hidrógeno es aquel enlace que se origina, producto de la fuerza de atracción que existe entre un átomo de oxígeno y otro de hidrógeno, nitrógeno o flúor, que tienen carga negativa.
Dicha atracción es conocida como “interacción “dipolo-dipolo” y crea una conexión entre el polo positivo de una partícula con el negativo de otra.
Enlace covalente
Es una fuerza que une a dos átomos de elementos no metálicos para formar una molécula.
los átomos comparten pares de electrones de su capa más superficial (llamada capa de valencia) para lograr la estabilidad de la molécula que se ha formado con el enlace.