Clasificación de mezclas
AGUA
Propiedades quimicas
°Su fórmula química es H₂O: un átomo de oxígeno ligado a dos de hidrógeno.
°La molécula del agua tiene carga eléctrica positiva en un lado y negativa en el otro, propiedad que ocasiona que sus moléculas se unan entre sí.
°Tienen un carácter dipolar: las moléculas de agua se orientan en torno a las partículas polares o iónicas, formando una envoltura de solvatación. Esto se traduce en una modificación de las propiedades de estas partículas.
°Contiene minerales y nutrientes de gran valor.
°El agua pura tiene un pH neutro de 7: esto significa que no es ácida ni básica.
°Reacciona con los óxidos ácidos, los óxidos básicos y el metal.
°Cuando se une el agua y las sales, se forman los hidratos.
Propiedades físicas
°Su densidad es de 1g/cm3.
°Amplio margen de temperaturas en fase líquida (0-100º C): su punto de congelación es a 0ºC, mientras que el de ebullición es a 100 °C a nivel del mar.
°Elevada constante dieléctrica: permite la disociación de la mayoría de las sales inorgánicas en su seno y permite que las disoluciones puedan conducir la electricidad.
°Calor específico y calor de vaporización elevados: esto hace que el calor liberado en reacciones bioquímicas exotérmicas sea fácilmente absorbido y/o eliminado con pequeña variación de la temperatura del individuo.
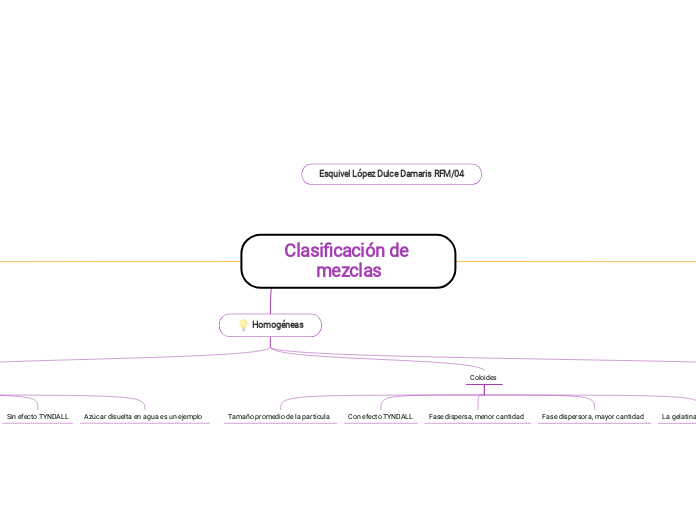
Homogéneas
Disoluciones
Muy pequeña
NO tiene método de separación
Soluto es la menor cantidad
Solvente es la mayor cantidad
Sin efecto TYNDALL
Azúcar disuelta en agua es un ejemplo
Coloides
Tamaño promedio de la partícula
Con efecto TYNDALL
Fase dispersa, menor cantidad
Fase dispersora, mayor cantidad
La gelatina es un ejmeplo
Método de separación
Destilación, Evaporación, Cristalización, Electroforesis.
Heterogéneas
Suspensiones
Partícula grande
Con efecto Tyndall
La filtración es el mejor método
Ejemplo: Medicamentos
Método de separación
Sublimación, Centrifugación, Imantación, Decantación y Tamización.