Funções Inorgânicas
Ácidos: substâncias que, em água, ionizam-se e produzem o cátion hidrônio (H+). Exemplos: ácido sulfúrico, ácido carbônico etc, Formula: HF + H20 = H30+ + F
Nomenclatura dos Ácidos: A fórmula geral de um ácido pode ser descrita como HxA, onde A representa o ânion que compõe o ácido e a nomenclatura gerada pode ser:
Terminação do ânion:
Eto:
Exemplo: Cloreto (Cl-)
Terminação do Ácido:
ídrico
Exemplo: ácido clorídrico (HCl)
Principais Ácidos:
Exemplos: acido clorídrico (HCl), ácido sulfúrico (H2SO4), ácido acético (CH3COOH), ácido carbônico (H2CO3) e ácido nítrico (HNO3).
Características do Ácido:
*Têm sabor azedo.
*Conduzem corrente elétricas, pois são soluções eletrolíticas.
*Formam o gás hidrogênio quando reagem com metais, como magnésio e zinco.
*Formam gás carbônico ao reagir com carbonato de cálcio.
*Alteram para uma cor específica os indiciadores ácido-base (papel de tornassol azul fica vermelho).
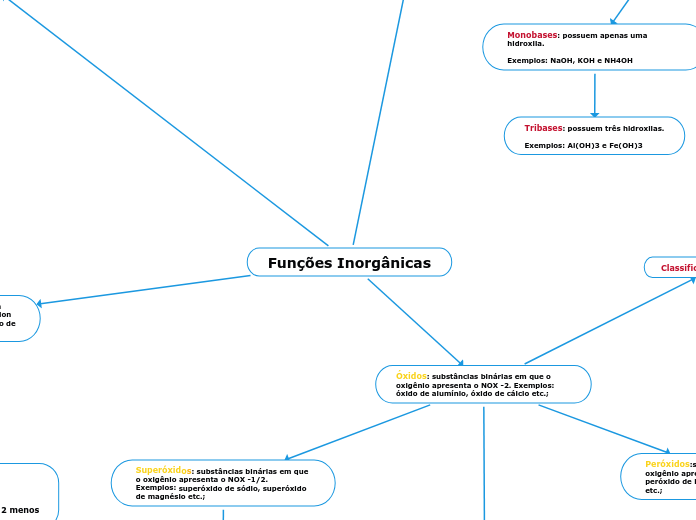
Bases: substâncias que, em água, dissociam-se e liberam o ânion hidróxido (OH-). Exemplos: hidróxido de sódio, hidróxido de magnésio etc.;
Classificação das bases
Monobases: possuem apenas uma hidroxila.
Exemplos: NaOH, KOH e NH4OH
Tribases: possuem três hidroxilas.
Exemplos: Al(OH)3 e Fe(OH)3
Dibases: possuem duas hidroxilas.
Exemplos: Ca(OH)2, Fe(OH)2 e Mg(OH)2
Tetrabases: possuem quatro hidroxilas.
Exemplos: Sn(OH)4 e Pb(OH)4
Nomenclatura
Bases com carga fixa:
Exemplo:
Metais alcalinos=Hidróxido de lítio=LiOH
Bases com carga variável:
Exemplo:
Cobre = Cu+ Hidróxido de cobre ICuOH=Hidróxido cuproso
Saís: substâncias que, em água, liberam um cátion diferente do hidrônio e um ânion diferente do hidróxido. Exemplos: cloreto de sódio, sulfato de alumínio etc.;
Classificação dos Saís
Solúveis:
Exemplo: Nitratos NO com 3 subscrito com menos sobrescrito
Insolúveis:
Exemplo:
Sulfetos reto S à potência de 2 menos fim do exponencial
Nomenclatura dos sais
Exemplo: ClCloreto
Fe3+
Ferro III
FeCl3
Cloreto de ferro III
Caracteristicas dos saís:
*São compostos iônicos.
*São sólidos e cristalinos.
*Sofrem ebulição em temperaturas altas.
*Conduzem corrente elétrica em solução.
*Têm sabor salgado.
Principais Saís
Exemplos: nitrato de potássio (KNO3), hipoclorito de sódio (NaClO), fluoreto de sódio (NaF), carbonato de sódio (Na2CO3) e sulfato de cálcio (CaSO4).
Óxidos: substâncias binárias em que o oxigênio apresenta o NOX -2. Exemplos: óxido de alumínio, óxido de cálcio etc.;
Peróxidos:substâncias binárias em que o oxigênio apresenta o NOX -1. Exemplos: peróxido de hidrogênio, peróxido de prata etc.;
Carbetos: substâncias binárias em que o carbono pode apresentar NOX -2 ou -4. Exemplos: carbeto de alumínio, carbeto de cálcio etc.
Superóxidos: substâncias binárias em que o oxigênio apresenta o NOX -1/2. Exemplos: superóxido de sódio, superóxido de magnésio etc.;
Hidretos: substâncias binárias em que o hidrogênio apresenta o NOX -2. Exemplos: hidreto de lítio, hidreto de alumínio etc.;
Sulfetos: substâncias binárias em que o enxofre apresenta o NOX -2. Exemplos: sulfeto de hidrogênio, sulfeto de sódio etc.
Classificação dos Óxidos
Iônicos:
Combinação do oxigênio com metais.
Exemplo: ZnO.
Moleculares:
Combinação do oxigênio com elementos não metálicos.
Exemplo: SO2.
Nomenclatura dos óxidos
Óxidos Iônicos:
Exemplos de óxidos com carga fixa:
CaO - Óxido de cálcio
Al2O3 - Óxido de alumínio
Exemplos de óxidos com carga varável:
FeO - Óxido de ferro II
Fe2O3 - Óxido de ferro III
Óxidos Moleculares:
Exemplos:
CO - Monóxido de carbono
N2O5 - Pentóxido de dinitrogênio
Características dos óxidos
*São substâncias binárias.
*São formados pela ligação do oxigênio com outros elementos, exceto o flúor.
*Óxidos metálicos, ao reagir com ácidos, formam sal e água.
*Óxidos não metálicos, ao reagir com bases, formam sal e água.
Principais óxidos
Exemplos: óxido de cálcio (CaO), óxido de manganês (MnO2), óxido de estanho (SnO2), óxido de ferro III (Fe2O3) e óxido de alumínio (Al2CO3).