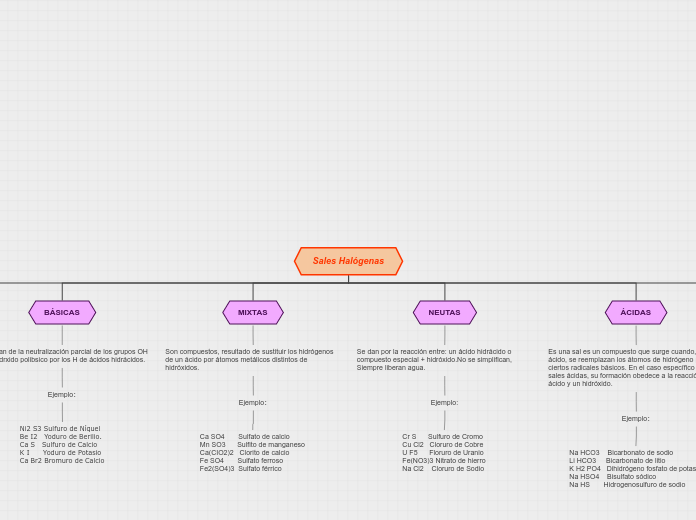
Sales Halógenas
DOBLES
Se forman por la neutralización total entre un hidrácidos y dos hidróxidos
Ejemplo:
Li Na S Sulfuro de litio y sodio
Ag Cu Se Selenuro de plata y cobre
Cs Na Te Teluro de cesio y sodio
Ag Li S Sulfuro de plata y litio
K Li Se Selenuro de litio y potasio
BÁSICAS
Se forman de la neutralización parcial de los grupos OH de un hidrxido polibsico por los H de ácidos hidrácidos.
Ejemplo:
Ni2 S3 Sulfuro de Níquel
Be I2 Yoduro de Berilio.
Ca S Sulfuro de Calcio
K I Yoduro de Potasio
Ca Br2 Bromuro de Calcio
MIXTAS
Son compuestos, resultado de sustituir los hidrógenos de un ácido por átomos metálicos distintos de hidróxidos.
Ejemplo:
Ca SO4 Sulfato de calcio
Mn SO3 Sulfito de manganeso
Ca(CIO2)2 Clorito de calcio
Fe SO4 Sulfato ferroso
Fe2(SO4)3 Sulfato férrico
NEUTAS
Se dan por la reacción entre: un ácido hidrácido o compuesto especial + hidróxido.No se simplifican, Siempre liberan agua.
Ejemplo:
Cr S Sulfuro de Cromo
Cu Cl2 Cloruro de Cobre
U F5 Floruro de Uranio
Fe(NO3)3 Nitrato de hierro
Na Cl2 Cloruro de Sodio
ÁCIDAS
Es una sal es un compuesto que surge cuando, en un ácido, se reemplazan los átomos de hidrógeno por ciertos radicales básicos. En el caso específico de las sales ácidas, su formación obedece a la reacción de un ácido y un hidróxido.
Ejemplo:
Na HCO3 Bicarbonato de sodio
Li HCO3 Bicarbonato de litio
K H2 PO4 Dihidrógeno fosfato de potasio
Na HSO4 Bisulfato sódico
Na HS Hidrogenosulfuro de sodio
HIDRÁCIDAS
Son compuestos ternarios no oxigenados ni hidrogenados que resultan de la sustitución total de los hidrógenos del ácido hidrácido por diferentes metales. La nomenclatura se indica el nombre del no metal más el nombre de los radicales hidrácidos.undefined
Ejemplo:
Ácido clorhídrico + hidróxido de sodio. El estado de oxidación del cloro para formar el ácido clorhídrico es el (1) y El estado de oxidación del sodio para formar el hidróxido de sodio es el (1)
Ácido bromhídrico + hidróxido férrico.