QUÍMICA BÁSICA

ÁTOMO
¿Qué es un átomo?
Estructura atómica
Protón
Subpartícula (+)
Neutrón
Subpartícula (+/-)
Electrón
Subpartícula (-)
Modelos atómicos
J. Dalton
Átomo: partícula fundamental de la materia
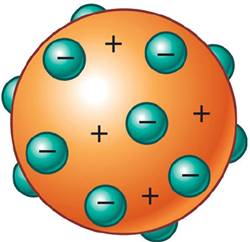
J. J. Thomson
Rayos catódicos = electrones
Rutherford
Átomo con núcleo
Bohr
Orbitales
TAREA
ENLACES
¿Qué es un enlace?
Iónicos
Covalentes
Polar
No polar
Coordinado
Clasificación de los elementos
Metales
No Metales
Metaloides
Familias y Periodos
Grupo o Familia
Columnas
Perido
Filas
Valencia
Electrones de valencia
Regla del octeto
Propiedades Periódicas
Electronegatividad
Potencial de Ionización
Puras
Formadas por un solo componente
Elementos
Unión de átomos del mismo tipo
Compuestos
Unión de dos o más elemento
Moléculas
Partícula más pequeña de un compuesto que conserva sus propiedades

Mezclas
¿Qué es una mezcla?
Homogéneas
Soluciones
Saturadas
No saturadas
Sobresaturadas
Heterogéneas
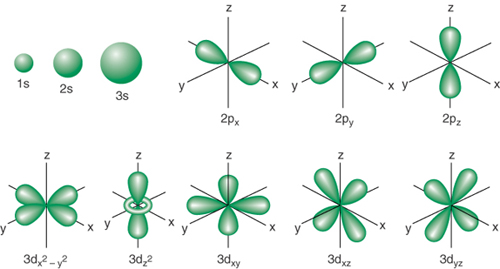
ORBITALES ATÓMICOS
¿Qué es un orbital?
Representación del espacio que ocupa un eletrón en un átomo
Niveles Energéticos
n: principal
l: secundario o azimutal
m: magnético
s: de spín
Configuración Electrónica