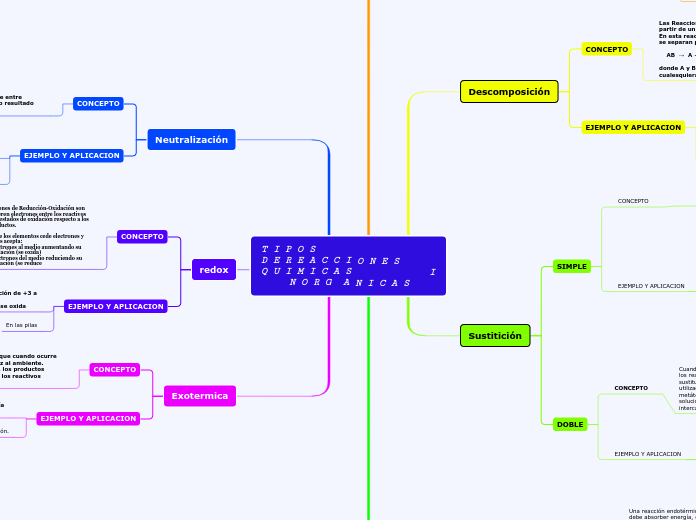
T I P O S D E R E A C C I O N E S Q U I M I C A S I N O R G A N I C A S
Combinación
CONCEPTO
Las Reacciones de Combinación o Reacciones de Síntesis son aquellas en las que dos sustancias se unen para formar un único producto.
EJEMPLO Y APLICACION
Combinación de óxidos con agua para formar hidróxidos:
Na2O + H2O → 2Na(OH)
CaO + H2O → Ca(OH)2
Descomposición
CONCEPTO
Las Reacciones de Descomposición son aquellas que a partir de un compuesto se forman dos o más sustancias. En esta reacción los átomos que forman un compuesto se separan para dar los productos según la fórmula:
AB → A + B
donde A y B representan dos sustancias químicas cualesquiera.
EJEMPLO Y APLICACION
Descomposición de Carbonatos y Bicarbonatos:
CaCO3 → CaO + CO2
Ca(HCO3)2 → CaO + CO2 + H2O
2NaHCO3 → Na2CO3 + CO2 + H2O
Agua
El agua puede descomponerse en hidrógeno y gas oxígeno por medio de una corriente eléctrica directa, de acuerdo a la siguiente ecuación:
Sustitición
SIMPLE
CONCEPTO
Cuando una reacción implica un elemento que desplaza a otro en un compuesto, se llama reacción de sustitución simple o reacción de reposición simple. También se utiliza el nombre de "reacción de desplazamiento"
EJEMPLO Y APLICACION
ejemplo, una tira de cobre sumergida en una solución de nitrato de plata desplazará átomos de plata, produciendo nitrato de cobre y precipitación de cristales del metal plata.
Cu(s) + 2AgNO3(aq) -> 2 Ag(s) + Cu(NO3)2(aq)
Si el metal zinc se sumerge en un ácido, desplazará al hidrógeno del ácido.
ZN(s) + 2HCl(aq) -> 2 H2(g) + ZnCl2(aq)
Generalmente, los metales activos, desplazarán el hidrógeno de los ácidos.
1. 2HCl + Zn —> ZnCl2 + H2
2. H2SO4 + Al —> Al2(SO4) + H2
3. Fe + Ag(NO3) —> Ag2 + Fe(NO3)
4. HPO3 + Ca —> CaPO3 + H
5. INi + K —> KNi + I
DOBLE
CONCEPTO
Cuando en una reacción aparece un intercambio de parte de los reactivos, la reacción se conoce como reacción de doble sustitución o reacción de doble reposición. Otro nombre utilizado para este tipo de reacciones es el de "reacciones de metátesis". Cuando los reactivos son compuestos iónicos en solución, los aniones y cationes de los compuestos se intercambian.
EJEMPLO Y APLICACION
la reacción entre el nitrato de plomo y el yoduro de potasio:
2KI(aq) + Pb(NO3)2(aq) -> 2KNO3(aq) + PbI(s)
1. H2CO3 + NaCl —->Na2 CO3 + 2HCl
2. HClO3 + Na2S4 —> Na2(ClO3) + Na4S2
3. FeS + Ca(NiO3) —> CaS + Fe(NiO3)3
Endotérmica
CONCEPTO
Una reacción endotérmica es aquella que para tener lugar debe absorber energía, en forma de calor o radiación, de sus alrededores. Generalmente, aunque no siempre, pueden reconocerse por un descenso de la temperatura en su entorno; o por el contrario, necesitan de una fuente de calor, como la obtenida por una llama ardiente.
EJEMPLO Y APLICACION
La producción de ozono en la atmósfera. Esta reacción es impulsada por la radiación ultravioleta del Sol, las moléculas de oxígeno (O2) son convertidos en ozono (O3), absorbiendo energía de dicha radiación en el proceso.
Reacción exotérmica
Neutralización
CONCEPTO
La neutralización es la reacción que ocurre entre sustancias básicas y ácidas; que dan como resultado una sal y agua.
EJEMPLO Y APLICACION
Cuando el ácido clorhídrico es neutralizado por el hidróxido de sodio, dando como resultado agua y una sal (cloruro de sodio).
HCl(ac) + NaOH(ac) → H2O(l) + NaCl(ac)
Pastas dentales. Los dentífricos contienen bicarbonato sódico, para disminuir la acides de la boca.
redox
CONCEPTO
Las Reacciones Redox o Reacciones de Reducción-Oxidación son aquellas en las cuales se transfieren electrones entre los reactivos produciéndose un cambio en los estados de oxidación respecto a los productos.
En las Reacciones Redox uno de los elementos cede electrones y otro los acepta:
Agente Reductor: cede los electrones al medio aumentando su estado de oxidación (se oxida)
Agente Oxidante: capta los electrones del medio reduciendo su estado de oxidación (se reduce
EJEMPLO Y APLICACION
Fe2O3 + 3CO → 2 Fe + 3 CO2
Reducción: el Fe pasa de un estado de oxidación de +3 a 0 por lo tanto se reduce
Oxidación: el C pasa de +2 a +4 por lo tanto se oxida
En las pilas
Exotermica
CONCEPTO
Una reacción exotérmica es aquella que cuando ocurre libera energía en forma de calor o luz al ambiente. Cuando este tipo de reacción ocurre, los productos obtenidos tienen menor energía que los reactivos iniciales.
EJEMPLO Y APLICACION
La fotosíntesis de las plantas: 6CO2 + 6H2O + energía → C6H12O6 + 6O2
La combustión.