
Velocidad de Reacción
Una reacción química puede descomponerse en una serie de etapas

1. La ruptura de los enlaces de los reactivos.
2. Formación del complejo activado.
3. Formación de los enlaces de los productos.
¿Qué es la velocidad de reacción?
La velocidad de una reacción es la rapidez con la que se forman los productos o se consumen los reactivos involucrados en dicha reacción.
La velocidad de reacción se define en términos del tiempo necesario para que desaparezca o se transforme una determinada cantidad de reactivos o para que se formen los productos correspondientes.

La velocidad de reacción depende de varios factores
La naturaleza de los reactantes
la velocidad de la reacción depende de qué elementos o sustancias estén involucrados en ella.
el estado físico de los reactantes también es importante. Si estos son gaseosos, la reacción será más rápida que si están en estado sólido.
La concentración de los reactantes
A mayor concentración, mayor velocidad de reacción.
La temperatura
A mayor temperatura, aumenta la energía de las moléculas, entonces aumenta su velocidad .
La presencia de catalizadores
Los catalizadores negativos o inhibidores aumentan el límite de energía mínima. Es decir, aumentan el requerimiento de energía.
Los catalizadores positivos o aceleradores disminuyen el límite de energía mínima. Al disminuirlo, la reacción se acelera.
Cinética

La cinética química se dedica a
los factores que afectan la velocidad
estudio de la velocidad de las reacciones químicas.
los mecanismos por los cuales ocurren las reacciones.
Energía de Activación
La energía de activación es una propiedad de cada reacción y depende de la clase de enlaces que se tengan que romper durante la misma.
la energía mínima necesaria para que se produzca una reacción química dada

Teoría de Colisiones
La teoría de colisiones establece que las moléculas deben colisionar (chocar) para reaccionar.
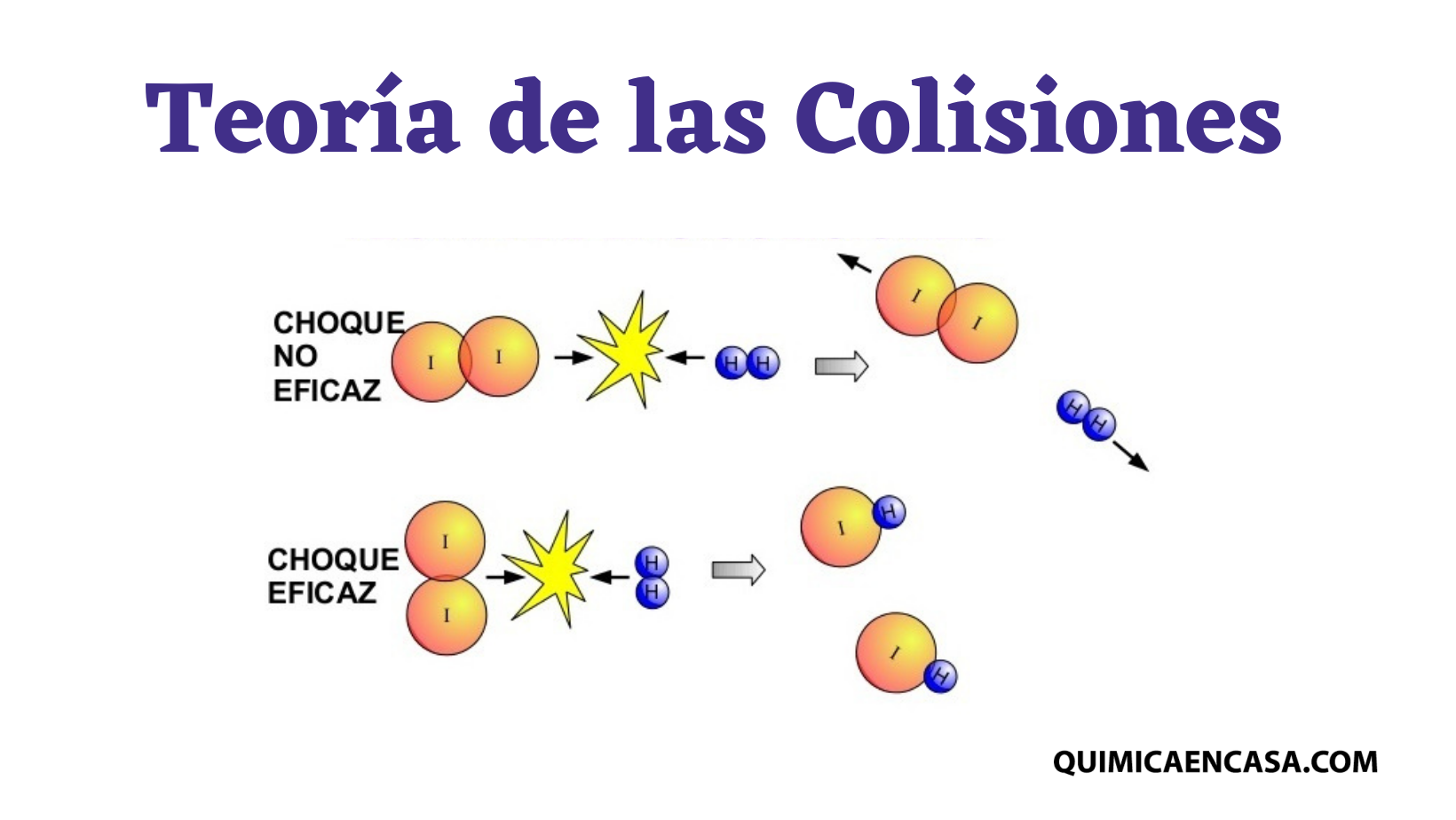
los átomos y moléculas de las distintas sustancias se hallan en continuo movimiento.
mientras mayor sea el número de choques
por unidad de tiempo, mayor será la probabilidad de que ocurra una reacción.
La energía necesaria para que sea posible una reacción: energía de activación (Ea).
