von ERICK EDUARDO TÉLLEZ ARTOLA Vor 5 Jahren
394
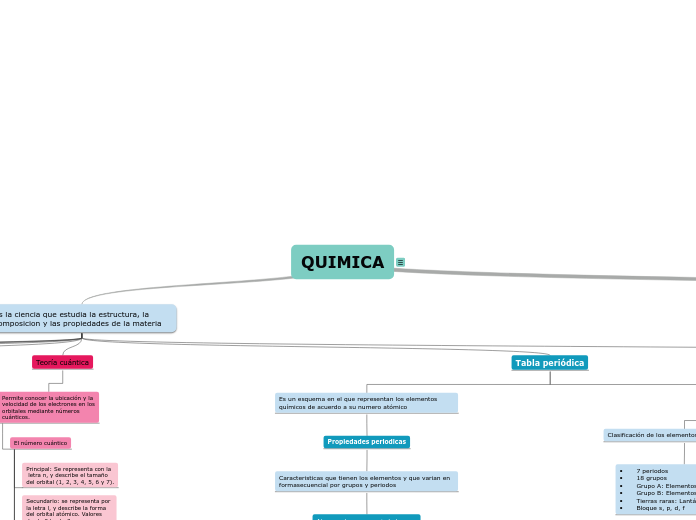
QUIMICA
von ERICK EDUARDO TÉLLEZ ARTOLA Vor 5 Jahren
394

Mehr dazu
Equipo 2
Modulo I y II
Integrantes:
Alejandro Betancourt Rodríguez. N.l: 2
Erick Eduardo Téllez Artola . Nl: 40
María Fernanda Olvera Martínez. N.l: 29
Estrella Anel Hernández segundo. N.l: 17
Estefanía Primero Manjarrez. N.l: 33
Type of narration
Muchas de las propiedades de los materiales dependen del tipo de los enlaces presentes en ellos.
Se puede tratar de la unión de átomos de una misma sustancia o de diferentes, en el primer se trata de un elemento y en el segundo de un compuesto.
Existen tres tipos de enlaces químicos
Metálicos
Formados por metales
Son buenos conductores de calor
No se representan en estructura de Lewis
Ejemplo: Ag2, Mg2, Al3.
Covalente (polar y no polar)
Se forman entre no metales, su electronegatividad es baja.
No conducen electricidad
En estructura de Lewis se representan con enlaces simples, dobles o triples, en todos los átomos se debe cumplir la regla del octeto (a excepción del hidrógeno, pues sólo soporta dos electrones de valencia).
Enlace covalente no polar
En el enlace covalente no polar, los átomos son no metales e iguales.
Ejemplo: H2, O3, S2.
Enlace covalente polar
En el enlace covalente polar, los átomos que lo componen deben ser no metales pero distintos
Ejemplo: H2O, CO2, SO.
Iónicos
Son aquellos que se forman entre un metal y un no metal.
Son altamente electronegativos y conducen electricidad
En estructura de Lewis se representan sólo con enlaces simples y el metal dona sus electrones de valencia al no metal para que éste complete su octeto.
Ejemplo: CaCl2, BaF2, RbCl.
• Contiene los 118 elementos ordenados. • Se divide tanto en Grupos como en Periodos.
• Clasifica a los elementos en base a su número atómico. • Los elementos se representan mediante sus Símbolos químicos.
Clasificación de los elementos de la tabla periódica
• 7 periodos • 18 grupos • Grupo A: Elementos representativos • Grupo B: Elementos de transición • Tierras raras: Lantánidos y actínidos • Bloque s, p, d, f
Propiedades periodicas
Caracteristicas que tienen los elementos y que varian en formasecuencial por grupos y periodos
Algunas de esas propiedades son
Potencial de ionización, electronegatividad, estructura electrónica, afinidad electrónica, valencia iónica, carácter metálico.
Metaloides
• Propiedades físicas intermedias de los metales y no metales • Son mejores conductores cuando aumenta la temperatura.
No metales
• Aislantes térmicos • Malos conductores de calor y de electricidad
Metales
• Alto punto de fusión • Dúctiles y maleables • Se oxidan
El número cuántico
Spin: se representa por la letra s, e indica el giro del electrón sobre su eje con dos posibles sentidos de rotación se consideran los valores de +1/2 y -1/2.
Magnético: se representa por la letra m, determina la orientación espacial del orbital puede tomar valores enteros desde -l hasta +l.
Secundario: se representa por la letra l, y describe la forma del orbital atómico. Valores desde 0 hasta 3.
Principal: Se representa con la letra n, y describe el tamaño del orbital (1, 2, 3, 4, 5, 6 y 7).
Niels Bhor 1913
El átomo está formado por un núcleo en el que se localizan los protones y neutrones y girando alrededor los electrones.
James Chadwick 1932
Concluyó que una partícula no tenía carga eléctrica, de esta forma descubrió el neutrón.
Ernest Ruhterford 1911
El centro hay un núcleo cargado positivamente, y alrededor electrones en movimiento. Dedujo que la mayor parte del átomo es espacio vacío.
Jean Baptise Perrin 1926
Sugirió que las cargas negativas no están inmersas en el átomo sino que son externas al pastel de pasas.
Jhon Thomson 1892
El modelo se consideró como “budín de pasas”.
Jhon Dalton 1808
Fue el primero en desarrollar un modelo atómico describía un al átomo como pequeñas partículas esféricas indivisibilidad e indestructibilidad.
Aristóteles Siglo IV a. de C
Inventó un quinto elemento del cual creía que estaba compuesto todo el universo exterior a la Tierra. Lo llamó: "éter".
Leucipo y Demócrito Siglo IV a. de C
Dividieron la materia y llegaron a una partícula a la cual llamaron átomo le atribuyeron la indivisibilidad indestructibilidad y eternidad.
El átomo es la partícula más pequeña de la materia.
Está compuesto por un núcleo, que se encuentra en su parte interna, y que contiene los protones y electrones.
Tiene una segunda estructura, llamada nube electrónica la cual rodea al núcleo y en la que se encuentran los electrones.
Energía calorífica: presencia del aumento de temperatura en un cuerpo y se obtiene por medio de electricidad, energía solar química entre otros.
Energía mecánica: energía de los cuerpos que tienen movimiento y se obtiene por medio de energía química, solar, eléctrica etc.
Asi mismo
Energía luminosa: energía transportada por fotones y esta se obtiene gracias a la energía eléctrica o energía solar.
La Energía eléctrica: es generada por los electrones de la materia y se produce por corriente además de energía mecánica, solar, química etc.
La energía química se obtiene a través de los cambios de la materia y gracias a esta se obtiene energía eléctrica, calorífica, mecánica etc.
Ley de la conservación de la materia
La ley de la conservacion o ley de Lomonósov-Lavoisier es una de las importantes de las ciencias, fue Elaborada independientemente por Mijaíl Lomonósov en 1745 y por AntoineLavoisier en 1785.
La ley de la conservación de la materia dice "En una reacción química ordinaria, la masa permanece constante, es decir, la masa consumida de los reactivos es igual a la masa obtenida de los productos" lo cual en otras palabras significa "la materia no se crea ni se destruye, se transforma".
Estados de agregación
Por ello, dentro de la la naturaleza en distintas formas, a las que se les denomina estados o formas de agregación las cuales (principalmente) son sólido, líquido y gaseoso
Gaseoso
No tienen forma ni volumen fijos. Una cosa característica de los gases es la gran variación de volumen que ocurren al cambiar las condiciones de temperatura y presión.
Liquido
Los líquidos no tienen una forma fija aunque sí tienen volumen. La variabilidad de forma depende del objeto en el que se le contiene.
Solido
Tienen forma y volumen constantes por lo que se caracterizan por la rigidez y regularidad de sus estructuras.
Matemáticas
Física
Historia
Estadística
Geología
Quimica organica
Química preparativa
Radioquímica
Iatroquímica
Química farmacéutica
Quimi urgía
Astro química
Ingeniería química
Quimica-fisica
Química industrial
Bioquímica