растворение
Растворение — переход молекул вещества из одной фазыв другую (раствор, растворенное состояние). Происходит в результате взаимодействия атомов, молекул растворителя и растворённого вещества и сопровождается увеличением энтропии, при растворении твёрдых веществ и её уменьшением при растворении газов.
растворы
Гомогенные (т.е. однородные) смеси переменного состава из двух или более веществ. Под переменным составом раствора понимают то простое обстоятельство, что соотношение смешанных друг с другом веществ может непрерывно изменяться в определенных пределах. Например, раствор соли можно разбавлять чистой водой или, наоборот, упаривать, но полученные при этом жидкости в любом случае будут называться растворами соли.
состав
растворитель
Из двух или нескольких компонентов раствора растворителем является тот, который взят в большем количестве и имеет то же агрегатное состояние, что и раствор в целом.Не всегда обязательно вода является растворителем – существуют и неводные растворы. Однако когда речь идет о водных растворах, воду считают растворителем и в тех случаях, когда ее меньше. Например, говорят о 96%-ном растворе этилового спирта в воде, а не о 4 %-ном растворе воды в спирте.
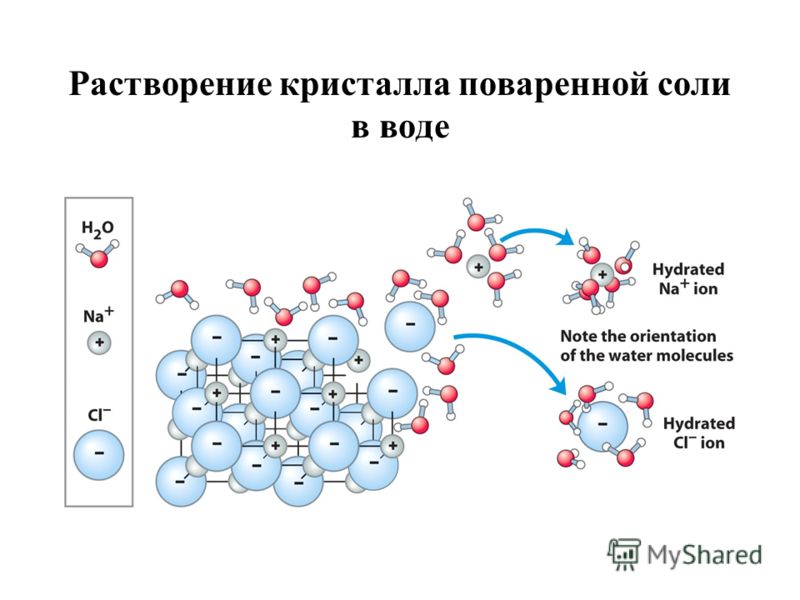
молекулы, вступившие в сольватацию/гидратацию
растворённое вещество
гидратированные/сольватированные ионы, молекулы
При растворении многих веществ их молекулы или ионы связываются с молекулами растворителя, образуя соединения, называемые сольватами. В частном случае, когда растворителем является вода, эти соединения называются гидратами.
агрегатное состояние
жидкие

твёрдые
В твердых растворах частицы одного вещества хаотично распределены среди частиц какого-нибудь другого, но обязательно твердого вещества. Например, водород охотно растворяется в некоторых металлах (платине, палладии), и это пример твердого раствора.

концентрация
ненасыщенные
Раствор, содержащий меньше вещества, чем в насыщенном.
насыщенные
Если молекулярные или ионные частицы, распределённые в жидком растворе присутствуют в нём в таком количестве, что при данных условиях не происходит дальнейшего растворения вещества, раствор называется насыщенным. (Например, если поместить 50 г NaCl в 100 г H2O, то при 20ºC растворится только 36 г соли). Насыщенным называется раствор, который находится в динамическом равновесии с избытком растворённого вещества. В растворе, где есть тепловое движение молекул, молекулы растворителя транспортируют частицы растворенного вещества из кристалла в раствор и обратно.Такая ситуация называется ДИНАМИЧЕСКИМ равновесием (равновесием в движении).
пересыщенные
Раствор, содержащий больше вещества, чем в насыщенном.
физические
При растворении вещества не меняются, после выпаривания растворов можно получить растворенное вещество в твердом состоянии. При растворении разрушается кристаллическая решетка растворенного вещества и ее частицы перемещаются в растворе, следовательно, растворение — это физический процесс. Для осуществления такого процесса необходимо затратить энергию.
диффузия
Явление диффузии можно рассмотреть на примере растворения сахара. Попадая в воду, молекулы сахара, находящиеся на поверхности кристаллов сахарного песка, образуют с молекулами воды межмолекулярные (водородные) связи. При этом с одной молекулой сахара связывается несколько молекул воды. Тепловое движение молекул воды заставляет связанные с ними молекулы сахара отрываться от кристалла и переходить в толщу молекул растворителя.Молекулы сахара, перешедшие из кристалла в раствор, могут передвигаться по всему объему раствора вместе с молекулами воды благодаря тепловому движению. Это явление называется диффузией.
При растворении перманганата калия диффузию частиц в растворе можно наблюдать визуально благодаря интенсивной малиновой окраске этого вещества.
химические
Молекулы растворенного вещества связываются с молекулами воды, и тогда фактически образуются новые химические соединения. Эти молекулярные ассоциаты не имеют постоянного состава. Их общее название — гидраты. При выпаривании растворов происходит разрушение гидратов и образование кристаллического вещества. Однако некоторые вещества способны образовывать устойчивые гидраты, которые могут содержать воду даже в кристаллическом состоянии. Такие вещества называются кристаллогидратами. Их можно выделить из раствора, осторожно выпаривая воду. В формулах таких веществ кристаллизационная вода указывается после формулы соединения со знаком умножения.Например: CuSO4 · 5H2O — медный купорос, FeSO4 · 7H2O — железный купорос. Образование гидратов, т.е. новых веществ, свидетельствует, что растворение — химический процесс.
подтема

гидратация/сольватация
Процесс взаимодействия растворителя и растворённого вещества называется сольватацией (если растворителем является вода - гидратацией).
изменение свойств
t замерзания
плотность
цвеет
и т.д.
энтропия
- Q
Происходит поглощение тепла как результат разрушения кристаллической решётки и разрыва химических связей в молекулах растворяемого вещества.Например, растворения нитрата аммония сопровождается охлаждением раствора. В этом случае на физический процесс разрушения кристаллической решетки тратится больше энергии, чем образуется при получении гидратов.
+ Q
Сопровождается выделением тепла по причине образования продуктов взаимодействия растворённого вещества с растворителем (гидраты) и др.Например, растворение серной кислоты сопровождается сильным разогревом раствора. Это результат химического взаимодействия между молекулами воды и растворенного вещества — гидратация сопровождается выделением энергии.