Clasificación de Compuestos
Inorgánicos
Cantidad de Elementos
Binarios
Son uniones de dos elementos, sin carbono ni hidrógeno, caracterizados por fórmulas y nombres específicos. Estos compuestos generan una gran gama de familias con propiedades y usos diversos.
Ejemplos
-Cloruro de sodio (NaCl)
-Óxido de magnesio (MgO)
-Sulfuro de hierro (FeS)
-Fluoruro de calcio (CaF2)
Terrarios
Compuestos que surgen de la unión de tres elementos químicos distintos, comúnmente sin hidrógeno ni carbono entre sus constituyentes.
Ejemplos
-Nitrato de sodio (NaNO3) -Sulfato de cobre(II) (CuSO4) -Carbonato de calcio (CaCO3) -Fosfato de aluminio (AlPO4)
Politómicos
Exhiben una estructura molecular con más de dos tipos de átomos. Esta diversidad en la composición molecular permite la inclusión de una amplia gama de elementos químicos, otorgando una complejidad adicional en comparación con los compuestos binarios y ternarios.
Ejemplos
-Agua (H2O)
-Dióxido de carbono (CO2)
-Dióxido de azufre (SO2)
-Amoníaco (NH3)
Tipos de Enlace
Covalentes
Polares
Los átomos comparten electrones de forma desigual debido a diferencias en electronegatividad. Esto crea una distribución desigual de carga eléctrica en la molécula, generando polos positivos y negativos.
Ejemplos
-Molécula de agua (H2O) -Ácido clorhídrico (HCl) -Dióxido de carbono (CO2)
No Polares
Los átomos comparten electrones de manera equitativa debido a que tienen una electronegatividad similar o idéntica, lo que resulta en una distribución uniforme de la carga eléctrica a lo largo de la molécula.
Ejemplos
-Molécula de nitrógeno (N2) -Molécula de oxígeno (O2) -Metano (CH4)
Iónicos
Se forma por la atracción electrostática entre un átomo de alta electronegatividad (no metal) y uno de baja electronegatividad (metal). El metal tiende a perder electrones para formar cationes cargados positivamente, mientras que el no metal tiende a ganar electrones para formar aniones con carga negativa.
Ejemplos
-Cloruro de Sodio (NaCl)
-Sulfato de Calcio (CaSO4)
-Nitrato de Amonio (NH4NO3)
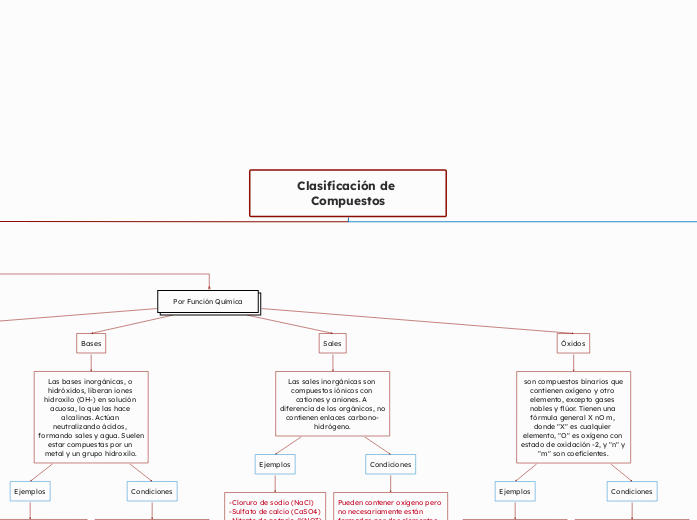
Por Función Química
Ácidos
También llamados ácidos minerales, contienen hidrógeno y al menos un elemento, excluyendo el carbono. Al descomponerse, liberan iones hidrógeno (H+), lo que los hace ácidos. Pueden encontrarse en forma de gases, líquidos o sólidos.
Ejemplos
-Ácido clorhídrico (HCl)
-Ácido sulfúrico (H2SO4)
-Ácido nítrico (HNO3)
Condiciones
-Sus fórmulas químicas siempre inician con el elemento hidrógeno.
-Pueden presentarse como simples, como HCl, o más complejos, como H2SO4.
Bases
Las bases inorgánicas, o hidróxidos, liberan iones hidroxilo (OH-) en solución acuosa, lo que las hace alcalinas. Actúan neutralizando ácidos, formando sales y agua. Suelen estar compuestas por un metal y un grupo hidroxilo.
Ejemplos
-Hidróxido de sodio (NaOH)
-Hidróxido de potasio (KOH)
-Hidróxido de calcio (Ca(OH)2)
Condiciones
Siempre terminan con "OH" en su fórmula química. A menudo, están compuestas por tres elementos, pero su característica distintiva es la presencia del grupo "OH".
Sales
Las sales inorgánicas son compuestos iónicos con cationes y aniones. A diferencia de los orgánicos, no contienen enlaces carbono-hidrógeno.
Ejemplos
-Cloruro de sodio (NaCl)
-Sulfato de calcio (CaSO4)
-Nitrato de potasio (KNO3)
Condiciones
Pueden contener oxígeno pero no necesariamente están formadas por dos elementos, o pueden estar formadas por dos elementos pero no terminar con oxígeno. No empiezan con hidrógeno ni terminan con "OH".
Óxidos
son compuestos binarios que contienen oxígeno y otro elemento, excepto gases nobles y flúor. Tienen una fórmula general X nO m, donde "X" es cualquier elemento, "O" es oxígeno con estado de oxidación -2, y "n" y "m" son coeficientes.
Ejemplos
-Dióxido de carbono (CO2)
-Trióxido de azufre (SO3)
-Monóxido de carbono (CO)
Condiciones
Contienen oxígeno y otro elemento, excluyendo gases nobles y flúor. Su fórmula siempre termina con oxígeno y están compuestos por dos elementos diferentes, ya sea un metal más oxígeno o un no metal más oxígeno.
Organicos
Según su Estructura Molecular
Alcanos
Compuestos de cadena lineal o ramificada, con enlaces simples entre átomos de carbono.
Alquenos
Compuestos con al menos un doble enlace carbono-carbono.
Alquinos
Compuestos con al menos un triple enlace carbono-carbono.
Cicloalcanos
Compuestos cuyos átomos de carbono forman un anillo cerrado.
Aromáticos
Compuestos que contienen uno o más anillos de benceno u otros anillos aromáticos.