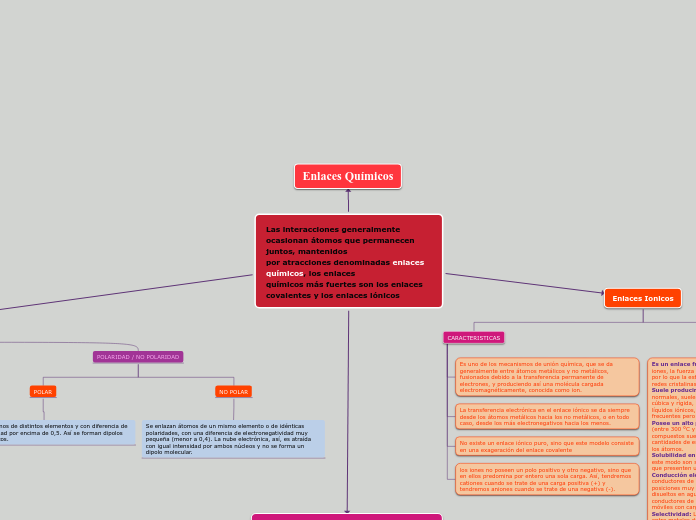
Las interacciones generalmente
ocasionan átomos que permanecen juntos, mantenidos
por atracciones denominadas enlaces químicos, los enlaces
químicos más fuertes son los enlaces covalentes y los enlaces iónicos
Enlaces Químicos
Enlaces Covalentes
CARACTERISTICAS
Un enlace covalente consiste en un par de electrones de
valencia compartidos por dos átomos que forman una molecula.
Ciertos enlaces covalentes se caracterizan por una concentracion de electronegatividad en uno de los dos atomos juntados, essto da como resultado una molecula con carga positiva y negativa en sus extremos.
Las moleculas covalentes se juntan con otras semejantes y forman estructuras mas complejas.
TIPOS DE ENLACE COVALENTE
Existen los siguientes tipos de enlace covalente, a partir de la cantidad de electrones compartidos por los átomos enlazados:
Simple: Los átomos enlazados comparten un par de electrones de su última capa (un electrón cada uno).
Doble: Los átomos enlazados aportan dos electrones cada uno, formando un enlace de dos pares de electrones.
Triple: En este caso los átomos enlazados aportan tres pares de electrones, es decir, seis en total.
Dativo :Un tipo de enlace covalente en que uno solo de los dos átomos enlazados aporta dos electrones y el otro, en cambio, ninguno.
POLARIDAD / NO POLARIDAD
POLAR
Se enlazan átomos de distintos elementos y con diferencia de electronegatividad por encima de 0,5. Así se forman dipolos electromagnéticos.
NO POLAR
Se enlazan átomos de un mismo elemento o de idénticas polaridades, con una diferencia de electronegatividad muy pequeña (menor a 0,4). La nube electrónica, así, es atraída con igual intensidad por ambos núcleos y no se forma un dipolo molecular.
La importancia de los enlaces químicos en la naturalezaundefined
Conociendo el mecanismo de los enlaces químicos, el hombre puede formar y separar sustancias. Para comprender bien los enlaces químicos debemos conocer antes el siguiente concepto, la importancia de los enlaces está en la energía que hay en estos, cada que se rompe un enlace se libera energía. También tienen importancia en la estabilidad que le da a las moléculas, enlaces débiles como puntos de hidrogeno hace a las moléculas más inestables, enlaces fuertes como puentes disulfuro garantizan moléculas muy estables.
Pequeñas diferencias en el tamaño ionico, son fundamentales en su importancia biológica.
Enlaces Ionicos
CARACTERISTICAS
Es uno de los mecanismos de unión química, que se da generalmente entre átomos metálicos y no metálicos, fusionados debido a la transferencia permanente de electrones, y produciendo así una molécula cargada electromagnéticamente, conocida como ion.
La transferencia electrónica en el enlace iónico se da siempre desde los átomos metálicos hacia los no metálicos, o en todo caso, desde los más electronegativos hacia los menos.
No existe un enlace iónico puro, sino que este modelo consiste en una exageración del enlace covalente
los iones no poseen un polo positivo y otro negativo, sino que en ellos predomina por entero una sola carga. Así, tendremos cationes cuando se trate de una carga positiva (+) y tendremos aniones cuando se trate de una negativa (-).
PROPIEDADES
Es un enlace fuerte: Dependiendo de la naturaleza de los iones, la fuerza de esta unión atómica puede ser muy intensa, por lo que la estructura de estos compuestos tiende a formar redes cristalinas muy resistentes.
Suele producir sólidos: A temperaturas y rangos de presión normales, suelen producir compuestos de estructura molecular cúbica y rígida, cristalina, dando origen así a sales. Existen líquidos iónicos, también, o “sales derretidas”, que son poco frecuentes pero sumamente útiles.
Posee un alto punto de fusión: Tanto el punto de fusión (entre 300 °C y 1000 °C) como el de ebullición de estos compuestos suele ser muy alto, pues se requiere grandes cantidades de energía para romper la atracción eléctrica entre los átomos.
Solubilidad en agua: La mayoría de las sales obtenidas de este modo son solubles en agua y otras soluciones acuosas que presenten un dipolo eléctrico (polos positivo y negativo).
Conducción eléctrica: En su estado sólido no son buenos conductores de electricidad, dado que los iones ocupan posiciones muy fijas en una red eléctrica. En cambio, una vez disueltos en agua o en solución acuosa, se tornan eficaces conductores de la electricidad dado que contienen partículas móviles con carga (iones).
Selectividad: Los enlaces iónicos pueden darse únicamente entre metales de los grupos I y II de la Tabla periódica, y los no metales de los grupos VI y VII.