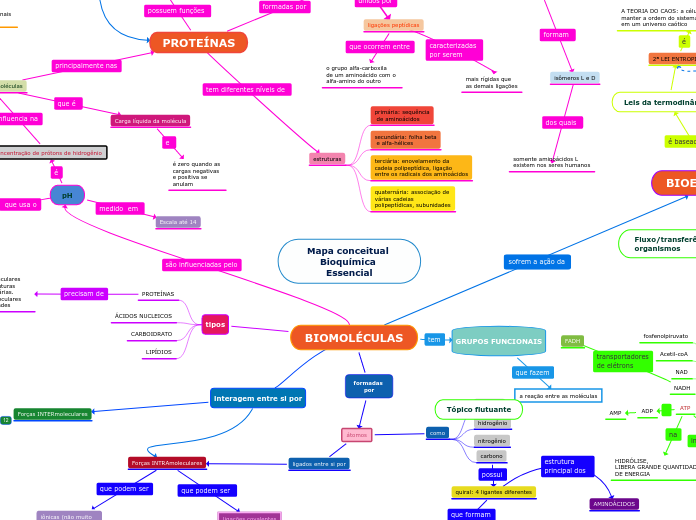
Mapa conceitual Bioquímica Essencial
Tópico flutuante
BIOENERGÉTICA
Metabolismo
Vias metabólicas
anabólicas
divergentes: moléculas menores
para produzir maiores
Biossíntese
catabólicas
convergente:
quebram moléculas
As reações mais recorrentes são
Reações de ligação (Ligases)
Reações de hidrolise
Reações de formação
Reações de isomerização
Reaçõe s de transferencia
Reação de oxiredução
Reguladas também por
Enzimas regulatórias (Alostéricas)
Disponibilidade de substrato ou de um metabolito
Ação de moléculas específicas
Caracteristicas específicas
São reguladores irreversiíveis.
Ocorre em lugares específicos
Define-se por
Transformação de matéria em energia
Auto manutenção celular
Se dispõe em
Sintese de macro moléculas
Obtenção de energia química
Síntese de degradação de Biomoléculas
Converter nutrientes e moleculas
Respiração celular
Divide-se em
Aeróbica
Glicólise
Fase glicolítica
Fase preparatória
Captação do a glicose do meio extracelular
para o meio intracelular, por meio de
biossinalizadores de insulina, onde fatalmente
sera fosforilada
Fase de Pagamento
A glicose já fosforilada é
utilizada dentro da célula
Ciclo do ácido Ciclico
Ciclo de Krebs
Cintratocintase
Isocitrato desidrogenase
Desidrogenase
Cadeia respiratória
Liberapor meio de
NADH
FADH2
Anaeróbica
Leis da termodinâmica
1ª LEI: CONSERVAÇÃO
DE ENERGIA
ENERGIA LIVRE DE GIBBS
alterada de acordo com a
concentração de reagentes
dentro da célula;
maneira de regular o METABOLISMO
Energia Livre Padrão:
em condição padrão
acoplamento de energia
reação
EXERGÔNICA ou
ENDERGÔNICA
Keq: Constante de equilíbrio
2ª LEI ENTROPIA
A TEORIA DO CAOS: a célula precisa de energia para
manter a ordem do sistema
em um universo caótico
Fluxo/transferência de energia nos organismos
energia química
moléculas transferidoras
fosfenolpiruvato
Acetil-coA
NAD
NADH
FADH
ATP
ADP
AMP
HIDRÓLISE,
LIBERA GRANDE QUANTIDADE
DE ENERGIA
TODAS AS CÉLULAS
CONSEGUEM USAR
ENZIMAS
nível estrutural
terciário e quaternário
apoenzima: a parte
proteica da enzima,
inativa
grupo prostético
coenzimas, são como
os cofatores mas orgânicas
vitaminas
a coenzima piridoxal
fosfato derivado da
vitamina do complexo B
cofatores: para serem funcionais
(como íons, Mg, Cu, Zn)
holoenzima
a quantidade de energia de ativação necessária (mas mesmo sem a enzima a reação acontece)
estado de transição que forma um complexo enzima-subtrato, (para isso ocorrer é necessário que existam interações)
não alteram a quantidade de energia livre
catalisar a reação
nos dois sentidos
Regulação Enzimática
alosteria
cooperatividade
ativadores ou inibidores
inibidores
reversíveis
competitivos
não competitivos/misto
incompetitivo
irreversíveis
modulação covalente
fosforilção e desfosforilação
ativação de zimogênios
catalíticas, específicas para
moléculas em que agem
sítio ativo onde
ligam os subtratos
produtos
são alostéricas
BIOMOLÉCULAS
interagem entre si por
Forças INTERmoleculares
formadas por
átomos
como
oxigênio
hidrogênio
nitrogênio
carbono
quiral: 4 ligantes diferentes
estereoisômeros
especificidade
sítio de ligação em enzima e substrato
AMINOÁCIDOS
ligados entre si por
Forças INTRAmoleculares
iônicas (não muito comuns na bioquímica)
elétrons
ligações covalentes
compartilhamento de elétrons
GRUPOS FUNCIONAIS
a reação entre as moléculas
tipos
PROTEÍNAS
interações intermoleculares para formar as estruturas terciarias e quaternárias. Interações intramoleculares formam as subunidades
ÁCIDOS NUCLEICOS
CARBOIDRATO
LIPÍDIOS
pH
Escala até 14
Concentração de prótons de hidrogênio
ionização das moléculas
Protonar ou desprotonar
Carga líquida da molécula
é zero quando as cargas negativas e positiva se anulam
PROTEÍNAS
aminoácidos
ligações peptídicas
o grupo alfa-carboxila
de um aminoácido com o
alfa-amino do outro
mais rígidas que
as demais ligações
influenciados pelo pH
nos grupos ionizáveis
códons de nucleotídeos do DNA
20 tipos de aminoácidos
diferentes grupos R
polares
hidrofóbicos apolares
ácidos
especiais
básicos
aromáticos
mais alguns tipos presentes
em diferentes formas de vida
monomêros formados por
um carbono quiral ligado a
um grupo amino e carboxila,
e uma cadeia lateral, hidrogênio
isômeros L e D
somente aminoácidos L
existem nos seres humanos
estruturas
primária: sequência
de aminoácidos
secundária: folha beta
e alfa-hélices
terciária: enovelamento da
cadeia polipeptídica, ligação
entre os radicais dos aminoácidos
quaternária: associação de
várias cadeias
polipeptídicas, subunidades
Transporte, defesa, estrutural,
pressão osmótica, catalítica,
receptor celular, sinalizadora
pH = - log [H+]
Ka= [H+][A-]/[HA]
quanto maior o valor de Ka,
mais forte é o ácido, pois há maior
liberação de H+, aumenta a
concentração de prótons,
diminui o pH e vice-versa
BIOSSINALIZAÇÃO
Neurotransmissores, fatores de crescimento, hormônios, luz, toque mecânico, moléculas de superfície, sinais de desenvolvimento, componentes da matriz extracelular, antígenos, gustativos, odorantes, feromônios
Molécula-sinal
receptor de um membrana celular (uma proteína), ativando segundos mensageiros intracelulares e por final moléculas efetoras
cascata de reações
proteínas, peptídeos,
aminoácidos, nucleotídeos...
especificidade
amplificação
adaptação
integração
transdução de sinais
seis tipos de receptores
proteína G
tirosina-cinase
guanilil-ciclase
canal iônico
de adesão
nuclear
tipos
PARÁCRINA
ENDÓCRINA
SINÁPTICA
DEPENDENTE DE CONTATO