PRUEBAS ANALÍTICAS
PARA DETERMINACION
DE PROTEÍNAS
SEPARACION Y CUANTIFICACION
DE FRACCIONES PROTEICAS
Electroforesis
En medio alcalino las proteinas tienen carga electrica negativa y se desplazan al polo positivo en la electroforesis. La distancia que recorren depende del punto isolectrico de cada proteina.

El resultado de la electroforesis es la aparición de una serie de bandas en el gel de agarosa correspondientes a cada una de las fracciones proteicas; dichas bandas se leen en un fotodensitómetro y son transformadas en un gráfico.
Inmunoelectroforesis
Las proteinas del gel de agarosa entran en contacto
con Anticuerpos antiproteinas y forman precipitados
Hay dos tipos:
Electroforesis inversa
las proteínas se colocan en un extremo del soporte y los Ac antiproteínas en el otro; se mueven en sentido contrario, se encuentran en el centro del soporte y forman bandas de precipitado
Electroforesis en cohete

el gel de agarosa lleva en su composicion Ac antiproteína;realizamos pocillos para las proteínas y se somete a un campo eléctrico; al moverse, las proteínas se encuentran con sus Ac específicos y forman bandas de precipitado en forma de cohete
Inmunofijación
Se echa Ac sobre el soporte electroforético, formándose precipitados Ag-Ac que quedan fijados en el gel. El material no fijado se elimina mediante lavado
Inmunodifusión
Radial(técnica cuali/cuantitativa),las proteínas difunden en el gel, que contiene Ac-antiproteinas en su composicion, y forman anillos de precipitado.
La variedad doble(técnica cualitativa)es idéntica a la contrainmunoelectroforesis, pero sin aplicar campo eléctrico
Cromatografía

técnica cuali/cuantitativa): puede separar proteínas aplicando técnicas de adsor-ción, exclusión molecular y afinidad
Western Blot
inmunotransferencia
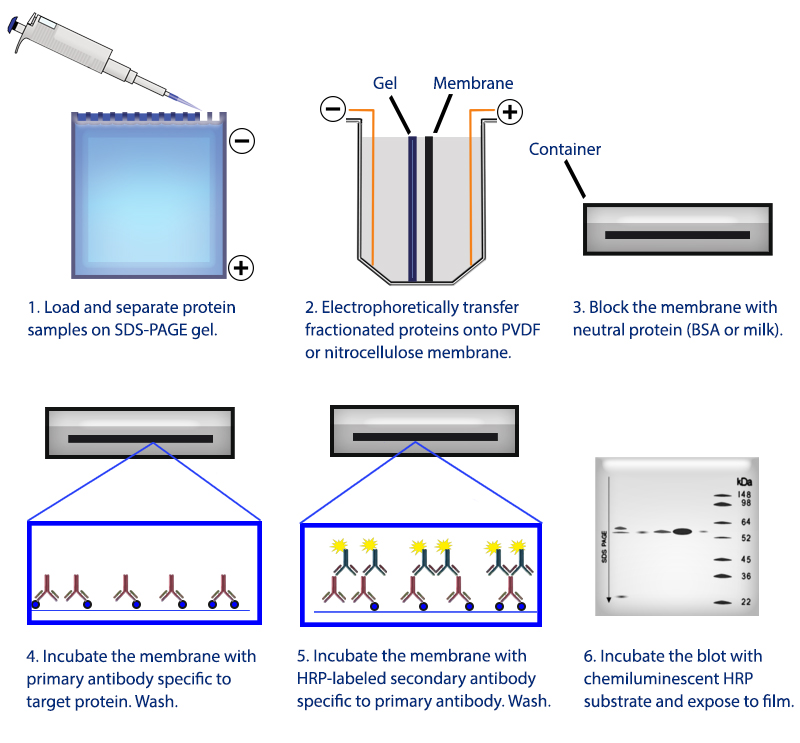
Tecnica cualitativa que permite identificar la presencia de determinadas proteínas. Tras la electroforesis, realizamos la transferencia a una membrana de nitrocelulosa. Y se identifican las proteínas con ayuda de Ac Mo específicos marcados, luego se revela.
Inmunodoting
Tecnica cualitativa. No necesita electroforesis. Se usa una membrana de nitrocelulosa fijada con Ac antiproteina marcados. Se pone en contacto con la muestra, se incuba, se lava y se revela.
PROTEÍNAS TOTALES
Refractometría

Se utiliza para sueros claros (sin hemólisis ni lipemia) y permite una valoración rápida y exacta.
Se realiza con refractometro
Método Biuret

Es la más utilizada. Se basa en la reaccion de enlaces peptidicos con las sales cúpricas en medio alcalino, da un compuesto de color azul-violaceo que se lee en el espectrofotómetro a 540 nm. No detecta aminoacidos ni dipeptidos.
Método Lowry
mide la absorbancia espectrofotométrica de un compuesto formado por el reactivo de Folin en contacto con una muestra pretratada con solución alcalina de cobre
Test de precipitación
asociado a turbidimetría
Hay que insolubilizar las proteinas para que dispersen la luz. Esto lo conseguimos por precipitación con polianiones y cationes, con sales diversas o anticuerpos antiproteina.
Método de fijacion
con colorantes
Se basan en la unión de las proteínas a ciertos colorantes (azul brillante de Coomasie, rojo Ponceau) con formación de un complejo coloreado que absorbe luz a determinadas longitudes de onda, y se mide en espectofotmetro.
Métodos semicuantitativos
Se usa tiras reactivas para orina y está basado en el "error proteico", es decir, en el cambio de color experimentado por ciertos indicadores de pH en contacto con proteínas; dicho cambio de color es independiente del pH
