Termodinámica metalúrgica
¿QUÉ ES TERMODINÁMICA?
Ciencia que estudia los cambios que se efectúan
en la materia y la energía asociada con dichos cambios
1883
FUNCIONES DE ESTADO.
Se llama así si al pasar de un estado inicial a otro final el incremento en dicha función es independiente de la trayectoria que une ambos estados
Funciones
Termodinámicas
Energía Interna (E)
Capacidad calorífica (Cp)
Entalpia (H)
Entropia (S)
Energia libre de Gibbs (G)
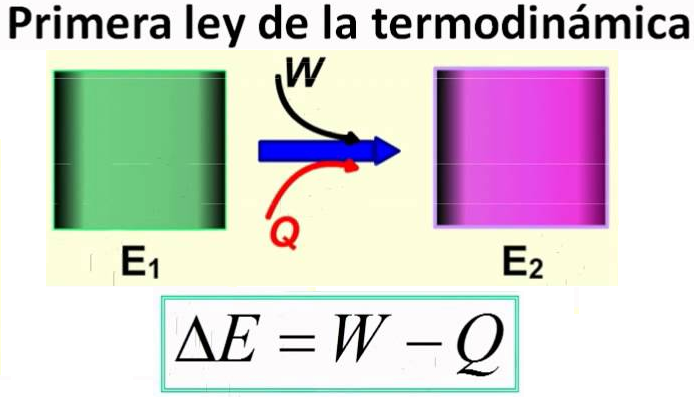
Primera Ley de la Termodinámica
La energía total de un sistema aislado es constante aunque esta puede cambiar de una forma a otra. La energía interna de un sistema puede variar como consecuencia del intercambio de calor y de trabajo con los alrededores
ΔE =Q+W
ΔE =E2+ E1=Q+W
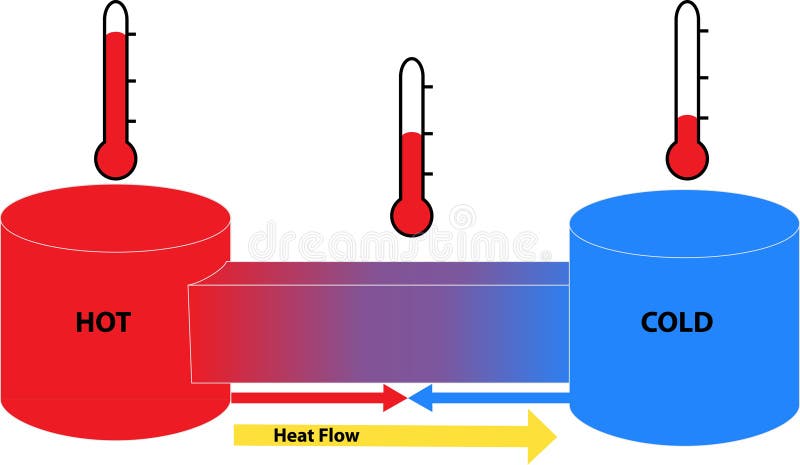
CALOR
Energía intercambiada entre un cuerpo y su entorno por el hecho de encontrarse a distinta temperatura

CALOR LATENTE
Energía requerida por una cantidad de sustancia para cambiar de fase
Calor de fusión
De sólido a líquido
Calor de vaporización
De líquido a gaseoso
Capacidad calorífica
Cantidad de energía necesaria parqa elevar 1°C la temperatura de una muestra determinada de material.
Unidades SI: julios/kelvin (kelvin) o cal/°C
Dos tipos de procesos
Capacidad calorífica a presión constante (Cp)
Capacidad calorífica a volumen constante (Cv)
Entalpía
H= E + PV
Permite expresar la cantidad de calor intercambiado durante una transformación isobárica.
La cantidad de energía que un sistema puede intercambiar con su entorno.

Proceso reversible
Al final del mismo el sistema puede restablecerse a su estado inicial
Los procesos reales nunca son reversibles pero pueden acercarse a esta condición
ENERGÍA DE GIBBS

Entropía
Magnitud termodinámica que indica el grado de desorden molecular de un sistema. La entropía de un sistema depende de sus estados inicial y final

Segunda Ley de la termodinámica
La cantidad de entropía del universo tiende a incrementarse en el tiempo
De la segunda ley de la termodinámica se deduce que para que un proceso sea espontáneo, la entropía del universo debe aumentar, esto es ∆Suniv>0
Enunciado de Kelvin - Planck
No es posible un proceso que convierta todo el calor absorbido en trabajo.
Enunciado de Clausiois
No es posible ningún proceso cuyo único resultado sea la extracción de calor de un cuerpo frío a otro más caliente.
PROCESOS
Reversible adibático
no entra ni sale calor por lo que δqrev
= 0 entonces: ∆S=0
Isobárico reversible
Se sabe que a presión constante el calor y el cambio de entalpia son iguales
Fusión de solidos
Evaporacion de un liquido
Propiedades
Extensivas
Dependen de la cantidad de materia en el sistema
Volumen
Masa
Intensivas
No dependen de la cantidad de materia
Temperatura
Densidad

TEMPERATURA
Parámetro que determina el sentido
el cual tiene efecto el flujo de calor
Escala de temperatura
K=Cº+273.15
ºC=5/9 (ºF-32)
ºF=9/5 (ºC+32)

SISTEMA
HOMOGÉNEO
1 fase
HETEROGÉNEO
2 o más fases
CERRADO
No intercambia materia con sus alrededores
ABIERTO

PRESIÓN
Se define como la
fuerza por unidad de área
Puede expresarse
Pascales
Torr
ATM
Presión atmosférica
Presión que ejerce el aire en el ambiente
y puede con la altura del lugar
TERMINOS
FASE
Una parte o el total e un sistema, propiedades físicas homogéneas.
COMPONENTE
Número mas pequeño de especies químicas que puede variar independientemente, mediante los cuales se puede expresar la composición de cada fase
PROCESO ADIABÁTICO
Aquel que ocurre dentro de un sistema y no existe transferencia de energía de o hacia sus alrededores

Ley de los Gases Ideales
LEY DE GASES IDEALES
P𝑽 =nRT

Ley de las Presiones Parciales de Dalton

Ecuación de Van der Waals
La ecuación trata de considerar el volumen finito de las moléculas individuales en un gas no ideal y las fuerzas de atracción entre ellos
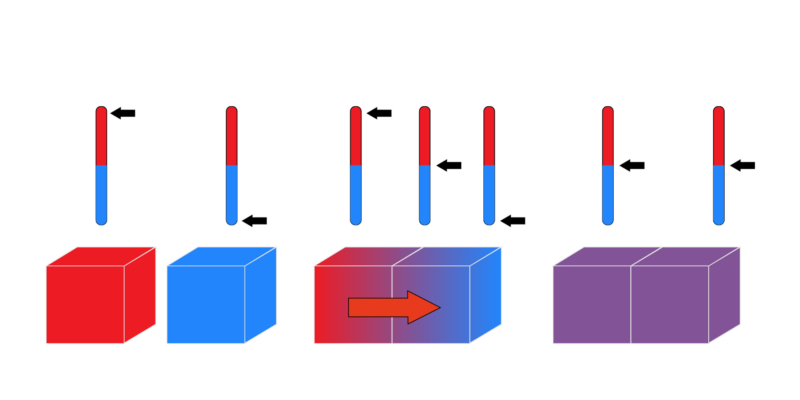
EQUILIBRIO TERMODINÁMICO
Equilibrio mecánico
La presión no cambia con el tiempo en algunos puntos
Equilibrio térmico
Temperatura constante en todos los puntos del sistema
Equilibrio químico
Composición química no cambia con el tiempo
Termoquímica
Estudio dirigido a las relaciones entre el calor, la temperatura, la presión y la composición química.
Primera ley de la termodinámica

ENERGÍA
Capacidad para realizar un trabajo
o transferir calor
W= F*d
La energía (J), en forma de trabajo, es usada para mover un objeto en contra de una fuerza
𝟏𝑱= 𝒌𝒈𝒎𝟐/𝒔𝟐
ESTADO TÉRMICO
Se refiere al estado de agregación
Cuatro propiedades observables o variables de estado
T
P
V
X