por Daniela gutierrez hace 1 año
421
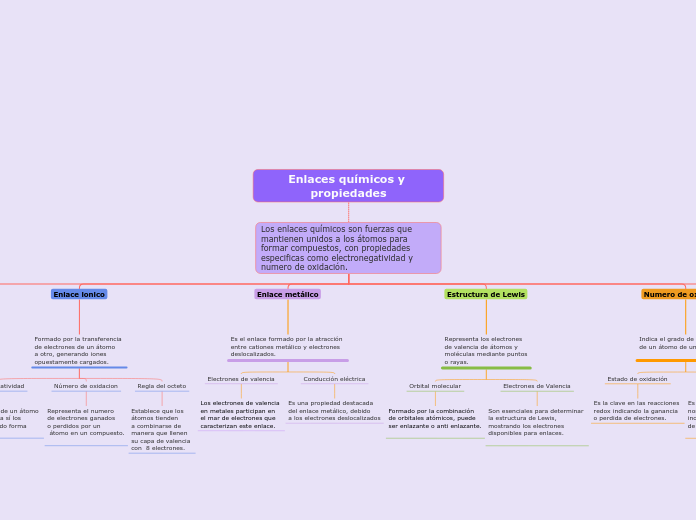
Enlaces químicos y propiedades
por Daniela gutierrez hace 1 año
421

Ver más
Excepciones
Algunos elementos pueden no seguir esta regla debido a su configuración electrónica particular.
Estabilidad molecular
Átomos que buscan completar su capa de valencia para alcanzar estabilidad.
Determinación
Es fundamental en la nomenclatura de compuestos inorgánicos y en el balanceo de ecuaciones químicas.
Estado de oxidación
Es la clave en las reacciones redox indicando la ganancia o perdida de electrones.
Electrones de Valencia
Son esenciales para determinar la estructura de Lewis, mostrando los electrones disponibles para enlaces.
Orbital molecular
Formado por la combinación de orbitales atómicos, puede ser enlazante o anti enlazante.
Conducción eléctrica
Es una propiedad destacada del enlace metálico, debido a los electrones deslocalizados
Los electrones de valencia en metales participan en el mar de electrones que caracterizan este enlace.
Regla del octeto
Establece que los átomos tienden a combinarse de manera que llenen su capa de valencia con 8 electrones.
Número de oxidacion
Representa el numero de electrones ganados o perdidos por un átomo en un compuesto.
Electronegatividad
Es la capacidad de un átomo para atraer hacia sí los electrones cuando forma un compuesto.
Electrones antienlazantes
Electrones que ocupan orbitales moleculares anti enlazantes, disminuyendo la estabilidad del enlace.
Eletrones enlazantes
Son los electrones compartidos entre átomos en un enlace covalente.
Electrones de valencia
Son aquellos electrones en la capa externa del átomo que participan en el enlace.