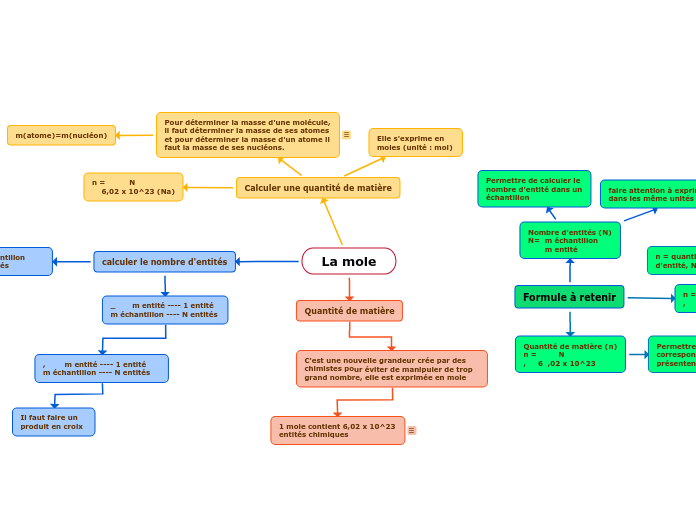
Formule à retenir
n = N , Na
n = quantité de matière, N = Nombre d'entité, Nombre d'Avogadro
Calculer la quantité de matière à partir du nombre d'entité
Quantité de matière (n) n = N , 6 ,02 x 10^23
Permettre de calculer la quantité de matière correspondante a partir du nbr d'entité présentent dans un échantillon
Nombre d'entités (N) N= m échantillon
m entité
faire attention à exprimer les deux masses dans les même unités
Permettre de calculer le nombre d'entité dans un échantillon
La mole
Calculer une quantité de matière
Elle s'exprime en moles (unité : mol)
Pour déterminer la masse d'une molécule, il faut déterminer la masse de ses atomes et pour déterminer la masse d'un atome il faut la masse de ses nucléons.
Exemple :
m(carbone) = 12 x m(nucléon)
m(nucléon) = 1,67 x 10^-27
donc m(carbone) = 12 x 1,67 x 10^-27
= 2,00 x 10^-26 kg
= 2,00 x 10^-23 g
m(atome)=m(nucléon)
n = N
6,02 x 10^23 (Na)
Quantité de matière
C'est une nouvelle grandeur crée par des chimistes pour éviter de manipuler de trop grand nombre, elle est exprimée en mole
1 mole contient 6,02 x 10^23 entités chimiques
Exemple : Un vert contient 10 mole d'eau, alors elle contient 10 x 6,02 x 10^23 molécule d'eau
calculer le nombre d'entités
N = m échantillon , m entités
_ m entité ---- 1 entité m échantillon ---- N entités
, m entité ---- 1 entité m échantillon ---- N entités
Il faut faire un produit en croix