Nombre: López Solano Elizabeth.
Durante el proceso
de ósmosis, el
disolvente difunde
de la solución de
menor concentración
(más diluida) al de
mayor concentración
a través de la mem-
brana semipermeable,
hasta equilibrar las
concentraciones.
Este fenómeno se
produce desde los
medios hipotónicos
hacia los medios
hipertónicos.
Una membrana
semipermeable
permite el paso
preferencial de
ciertas sustancias
presentes en una
disolución frente
a otras.
Sustancia polar
Hay una diferencia en la electronegatividad entre los átomos, con un polo positivo y uno negativo.
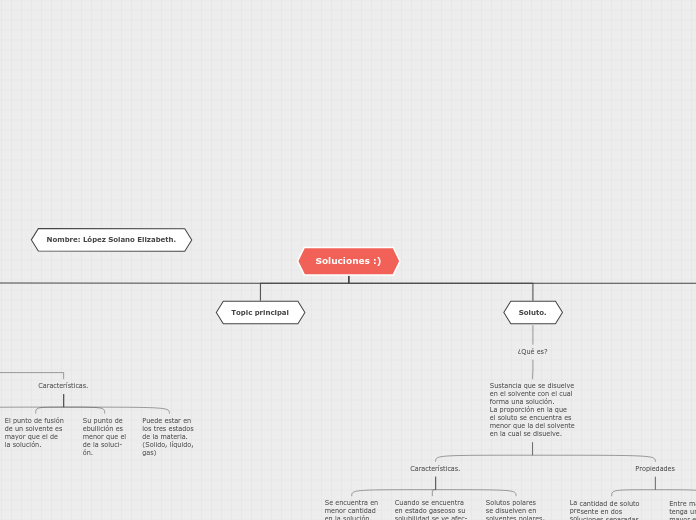
Soluciones :)
Solución.
Mezcla homogénea de dos o mas sustancias
químicas puras.
Toda solución química tiene como mínimo
dos componentes los cuales son el soluto
y disolvente.
Soluto.
Sustancia que se disuelve
en el solvente con el cual
forma una solución.
La proporción en la que
el soluto se encuentra es
menor que la del solvente
en la cual se disuelve.
Propiedades
Entre más partículas
tenga un soluto,
mayor es el punto
de ebullición de la
solución y menor
es el punto de fusión.
La cantidad de soluto
presente en dos
soluciones separadas
por una membrana
semipermeable tiene
un efecto en el fenómeno
de la ósmosis.
Solutos polares
se disuelven en
solventes polares,
solutos no polares
se disuelven en
solventes no pola-
res.
Cuando se encuentra
en estado gaseoso su
solubilidad se ve afec-
tada por la presión, el
volumen y la tempera-
tura.
Se encuentra en
menor cantidad
en la solución
Topic principal
Disolvente.
¿Qué es?
Características.
Puede estar en
los tres estados
de la materia.
(Solido, líquido,
gas)
Su punto de
ebullición es
menor que el
de la soluci-
ón.
El punto de fusión
de un solvente es
mayor que el de
la solución.
Se encuentra en
mayor proporción
en la solución.
Tiene la propiedad de
disolver otra sustancia
soluble para formar
una mezcla uniforme-
mente dispersa a nivel
molecular o iónico.
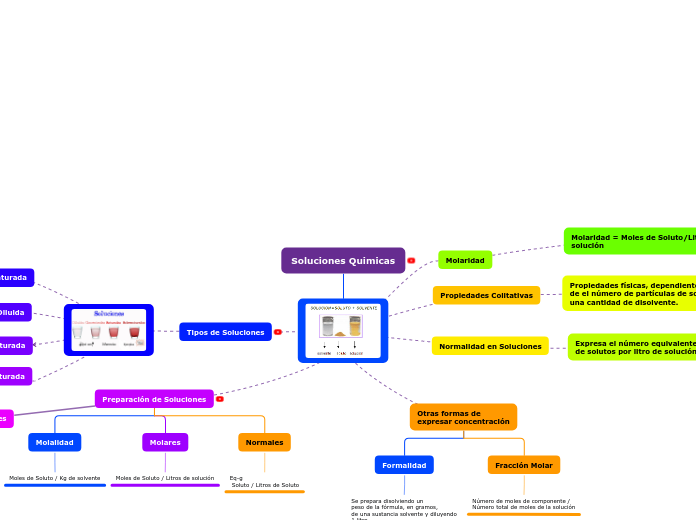
Tipos de disolventes.
Apolares.
Sustancias químicas o
mezclas de las mismas
que son capaces de
disolver sustancias
hidrosolubles, debido a
propiedades disolventes
tiene múltiples aplica-
caciones en la tecnolo-
gías industriales y en
los laboratorios de
investigación.
Ejemplos:
Benceno.
Cloroformo.
Éter dietílico.
Polares.
Disuelven sustancias
polares por interacci-
nes electrostáticas en-
tre dipolos. Ejemplo:
Agua.