La Química
Concepto
La palabra química proviene de una variable del latín y de raíces árabes que son chimica, chimia, alkimya, referencia de alquimia, para posteriormente pasar por una nueva forma de definir a la química del tipo moderno que empezó a diferenciarse de la alquimia refiriéndose a la variedad de los componentes y composiciones definiendo las propiedades de una o sobre una materia y las posibles transformaciones que surjan o experimentes sin causar ningún cambio, alteraciones o modificaciones sobre la misma o sus elementos, de la cual una materia es conformada.

Clasificación
Quimica General
La química general es la ciencia que estudia la composición de la materia., las propiedades de estas y las reacciones de los elementos cuando se juntan o se separan, cuales son las reacciones y también si cambian influenciados por el calor, el frio, la humedad, la luz , la electricidad etc. además diferencia los materiales orgánicos de los inertes.
Química Descriptiva
Es una rama de la química que estudia las características, propiedades y composición de las sustancias, así como las reacciones de estas con otras y sus formas de obtención.
Esta parte de la química se divide a su vez en dos ramas: la química inorgánica y la orgánica.
Describe las propiedades de los elementos según su posición en la tabla periódica y sus configuraciones electrónicas, habla de los estados naturales de cada elemento así como de sus métodos industriales y de laboratorio, usados para su preparación y uso. Trata información de cada elemento y sus compuestos.

Química Inorgánica
La química inorgánica se encarga del estudio integrado de la formación, composición, estructura y reacciones químicas de los elementos y compuestos inorgánicos (por ejemplo, ácido sulfúrico o carbonato cálcico); es decir, los que no poseen enlaces carbono-hidrógeno, porque éstos pertenecen al campo de la química orgánica.
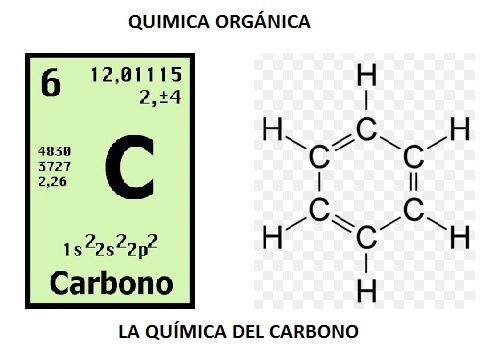
Química Orgánica
La química orgánica es la disciplina científica que estudia la estructura, propiedades, síntesis y reactividad de compuestos químicos formados principalmente por carbono e hidrógeno, los cuales pueden contener otros elementos, generalmente en pequeña cantidad como oxígeno, azufre, nitrógeno, halógenos, fósforo y silicio.
Multimedia
Tabla Periódica
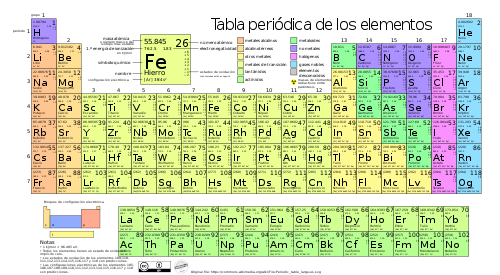
La tabla periódica o sistema periódico es un esquema que muestra la estructura y disposición de los elementos químicos, de acuerdo a una ley periodicidad, la cual consiste en que “las propiedades de los elementos son una función periódica de sus números atómicos”.
Subtema
Las filas de la tabla periódica se conocen como períodos. Se numeran del 1 al 7 en sentido descendente; el período 1 es el período superior y el período 7 es el inferior. A mayor período, es decir, al descender por la tabla periódica, aumenta el número de niveles energéticos del átomo en estado fundamental (no excitado).
Cada columna de la tabla periódica es un grupo y hay un total de 18. Los grupos se unen para formar 4 bloques en función del último orbital ocupado: s, p, d y f.
Metales alcalinos
Los metales alcalinos incluyen a los elementos del grupo 1, desde el Litio (Li) hasta el Francio (Fr). El Hidrógeno está en el grupo 1 pero no es un metal alcalino, de hecho el hidrógeno muestra muy pocas características metálicas y es frecuentemente categorizado como un no metal.
Metales alcalinotérreos
Los metales alcalinotérreos coinciden con el grupo 2, desde el berilio (Be) hasta el radio (Ra). Suelen tener un punto de fusión muy alto y sus compuestos óxidos forman soluciones alcalinas muy básicas.
Lantánidos
Los lantánidos son el grupo formado desde el elemento con número atómico 57, el lantano (La), que le da nombre al grupo, hasta el elemento de número atómico 71, el Lutecio (Lu). La capa de valencia de los lantánidos es 4f; junto a los actínidos (5f) forman el bloque f.
Actínidos
Los actínidos es el grupo que comprende desde el número atómico 89, el Actinio (Ac), hasta el 103, el Lawrencio (Lr). La capa de valencia es 5f y son todos son radioactivos. Son elementos poco abundantes, de hecho solo el torio (Th) y el uranio (U) se dan en la naturaleza en cantidades significativas.
Metales de transición
Los metales o elementos de transición se sitúan en el centro de la tabla periódica, en el bloque d, que abarca desde el grupo 3 al grupo 12. Se caracterizan por tener un orbital d parcialmente ocupado en su configuración electrónica.
Metales postransicionales
Los metales postransicionales, a veces referidos simplemente como “otros metales”, son el Aluminio (Al), Galio (Ga), Indio (In), Talio (Tl), Estaño (Sn), Plomo (Pb) y Bismuto (Bi). Estos elementos se consideran metales pero suelen tener características metálicas más moderadas; por ejemplo, suelen ser más blandos o relativamente peores conductores.
Metaloides
Los metaloides son sustancias con propiedades intermedias entre los metales y los no metales. Se comportan típicamente como no metales, pero pueden presentar aspecto metálico o conducir la electricidad en algunas circunstancias. Los elementos metaloides, también conocidos como semimetales, son el Boro (B), Silicio (Si), Germanio (Ge), Arsénico (As), Antimonio (Sb), Telurio (Te) y Polonio (Po); a veces se incluye también al Astato (At).
No metales
Bajo el término “no metales” se englobarían a todos los demás elementos, desde los halógenos a los gases nobles, pero es muy frecuente que se utilice para elementos no metálicos que no se pueden clasificar como halógenos ni como gases nobles, es decir, para Hidrógeno (H), Carbono (C), Nitrógeno (N), Fósforo (P), Oxígeno (O), Azufre (S) y Selenio (Se).
Halógenos
Los halógenos son un tipo de elementos no metálicos que coinciden con el grupo 17 de la tabla periódica, lo que abarca desde el Flúor (F) hasta el Astato (At), este último a veces incluido en los metaloides. Los halógenos suelen ser elementos muy reactivos, por eso es común que se encuentren en la naturaleza formando parte de otras sustancias y rara vez en forma pura.
Gases nobles
Los conocidos como gases nobles coinciden con el grupo 18. Todos estos elementos son gaseosos en condiciones normales de presión y temperatura, no tienen color, no tienen olor, y su gran estabilidad les hace merecedores del adjetivo común de ser “inertes químicamente”.
Nomenclaturas
Nomenclatura química son las reglas y regulaciones que rigen la designación (la identificación o el nombre) de las sustancias químicas.
Los compuestos orgánicos son los que contienen carbono, comúnmente enlazado con hidrógeno, oxígeno, boro, nitrógeno, azufre y algunos halógenos. El resto de los compuestos se clasifican como compuestos inorgánicos. Éstos se nombran según las reglas establecidas por la IUPAC.

TIPOS
Nomenclatura clásica
También se le conoce como nomenclatura tradicional. Es el nombre que se obtiene al combinar 2 palabras que logran identificar un determinado compuesto, tomando siempre en cuenta la función química que lo forma.
Nomenclatura stock
En este tipo de nomenclatura se escribe después del nombre del elemento o sustancia el número romano entre paréntesis que representa su estado de oxidación o valencia del elemento que forma parte de la sustancia o compuesto químico.
Nomenclatura Estequiométrica
También se le conoce como nomenclatura de atomicidad, nomenclatura tradicional o nomenclatura sistemática o IUOAC. Esta llega a representar las proporciones y la naturaleza de los elementos que conforman una sustancia. Se crea tomando como base un sistema de sufijos y prefijos, lo cual muestra la estequiometria en el primer caso, y en el segundo la naturaleza de las especies implicadas.
