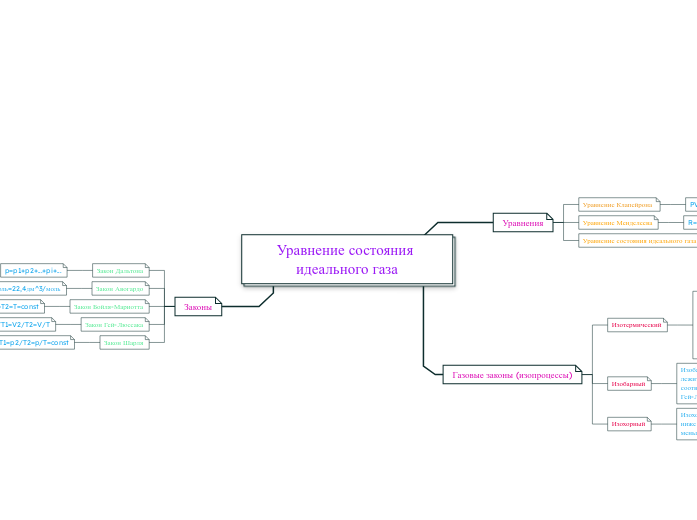
Уравнение состояния идеального газа
Уравнения
Уравнение Клапейрона
PV/T=const
Уравнение Менделеева
R=Na*k=8,31Дж/моль*К
Уравнение состояния идеального газа
pV=m/M*RT
Газовые законы (изопроцессы)
Изотермический
Изотерма соответствующая более высокой температуре T1, лежит на графике выше изотермы,
соответствующей более низкой температуре T2. Если значения давления и температуры в различных точках объёма разные, то в этом случае газ
находится в неравновесном состоянии. Закон Бойля – Мариотта.
Изобарный
Изобара соответствующая более высокому давлению p2 лежит на графике ниже изобары
соответствующей более низкому давлению p1. Закон Гей-Люссака.
Изохорный
Изохора соответствующая большему объему V2 лежит ниже изохоры, соответствующей
меньшему объему V1. Закон Шарля.
Законы
Закон Дальтона
p=p1+p2+...+pi+...
Закон Авогардо
V0=0,224м^3/моль=22,4дм^3/моль
Закон Бойля-Мариотта
p1V1=p2V2=pV=const; T1=T2=T=const
Закон Гей-Люссака
p=const; p1=p2=p; V1/T1=V2/T2=V/T
Закон Шарля
V1=V2=V=const; p1/T1=p2/T2=p/T=const