Balanceamento de reações | por Maria Eduarda Fernandes
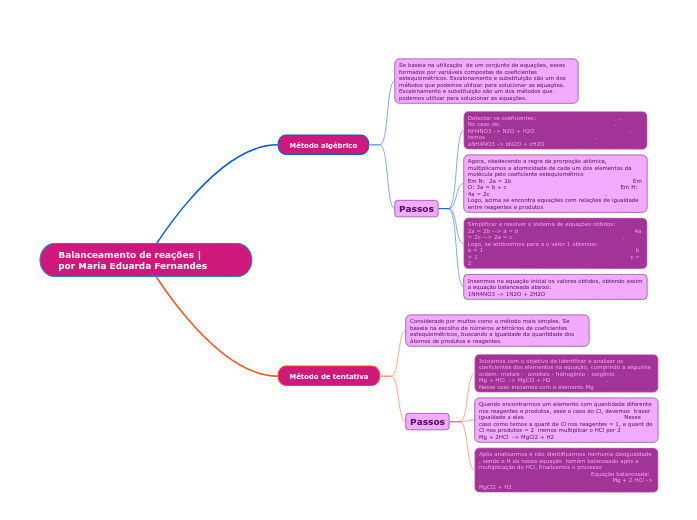
Método algébrico
Se baseia na utilização de um conjunto de equações, esses formados por variáveis compostas de coeficientes estequiométricos. Escalonamento e substituição são um dos métodos que podemos utilizar para solucionar as equações. Escalonamento e substituição são um dos métodos que podemos utilizar para solucionar as equações.
Passos
Detectar os coeficientes: . No caso de: . NH4NO3 -> N2O + H2O . temos . aNH4NO3 -> bN2O + cH2O
Agora, obedecendo a regra da prorpoção atômica, multiplicamos a atomicidade de cada um dos elementos da molécula pelo coeficiente estequiométrico Em N: 2a = 2b Em O: 3a = b + c Em H: 4a = 2c . Logo, acima se encontra equações com relações de igualdade entre reagentes e produtos
Simplificar e resolver o sistema de equações obtidos: 2a = 2b --> a = b 4a = 2c --> 2a = c . Logo, se atribuirmos para a o valor 1 obtemos: a = 1 b = 1 c = 2
Inserimos na equação inicial os valores obtidos, obtendo assim a equação balanceada abaixo: 1NH4NO3 -> 1N2O + 2H2O
Método de tentativa
Considerado por muitos como o método mais simples. Se baseia na escolha de números arbitrários de coeficientes estequiométricos, buscando a igualdade da quantidade dos átomos de produtos e reagentes.
Passos
Iniciamos com o objetivo de identificar e analisar os coeficientes dos elementos na equação, cumprindo a seguinte ordem: metais - ametais - hidrogênio - oxigênio Mg + HCl -> MgCl2 + H2 . Nesse caso iniciamos com o elemento Mg
Quando encontrarmos um elemento com quantidade diferente nos reagentes e produtos, esse o caso do Cl, devemos trazer igualdade a eles. Nesse caso como temos a quant de Cl nos reagentes = 1, e quant de Cl nos produtos = 2 iremos multipilcar o HCl por 2 Mg + 2HCl -> MgCl2 + H2
Após analisarmos e não identificarmos nenhuma desigualdade , sendo o H da nossa equação tamém balanceado após a multiplicação do HCl, finalizamos o processo . Equação balanceada: . Mg + 2 HCl -> MgCl2 + H2