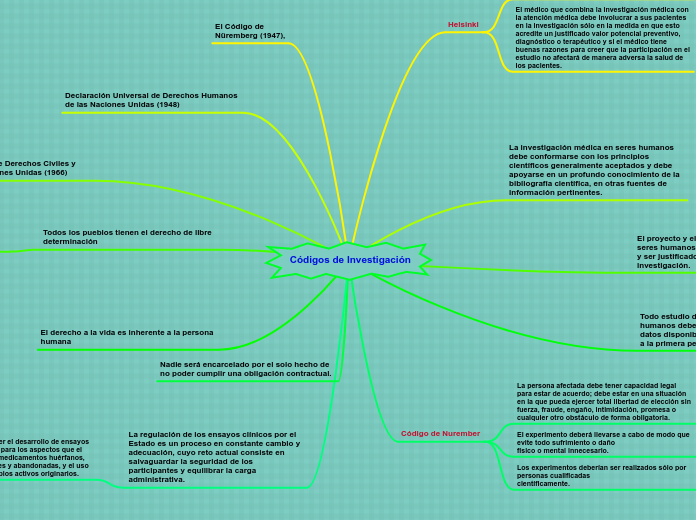
Códigos de Investigación
Helsinki
Velar solícitamente y ante todo por la salud de mi paciente.
El médico que combina la investigación médica con la atención médica debe involucrar a sus pacientes en la investigación sólo en la medida en que esto acredite un justificado valor potencial preventivo, diagnóstico o terapéutico y si el médico tiene buenas razones para creer que la participación en el estudio no afectará de manera adversa la salud de los pacientes.
La investigación médica en seres humanos debe conformarse con los principios científicos generalmente aceptados y debe apoyarse en un profundo conocimiento de la bibliografía científica, en otras fuentes de información pertinentes.
El proyecto y el método de todo estudio en seres humanos deben describirse claramente y ser justificados en un protocolo de investigación.
Todo estudio de investigación con seres humanos debe ser inscrito en una base de datos disponible al público antes de aceptar a la primera persona.
Código de Nurember
La persona afectada debe tener capacidad legal para estar de acuerdo; debe estar en una situación en la que pueda ejercer total libertad de elección sin fuerza, fraude, engaño, intimidación, promesa o cualquier otro obstáculo de forma obligatoria.
El experimento deberá llevarse a cabo de modo que evite todo sufrimiento o daño
físico o mental innecesario.
Los experimentos deberían ser realizados sólo por personas cualificadas
científicamente.
El Código de
Nüremberg (1947),
Declaración Universal de Derechos Humanos de las Naciones Unidas (1948)
Pacto Internacional de Derechos Civiles y Políticos de las Naciones Unidas (1966)
Todos los pueblos tienen el derecho de libre determinación
Las autoridades competentes cumplirán toda decisión en que se haya estimado
procedente el recurso.
El derecho a la vida es inherente a la persona humana
Nadie será encarcelado por el solo hecho de no poder cumplir una obligación contractual.
La regulación de los ensayos clínicos por el Estado es un proceso en constante cambio y adecuación, cuyo reto actual consiste en salvaguardar la seguridad de los participantes y equilibrar la carga administrativa.
El reto actual es promover el desarrollo de ensayos clínicos desde el Estado para los aspectos que el país necesita, incluidos medicamentos huérfanos, enfermedades prevalentes y abandonadas, y el uso terapéutico de los principios activos originarios.