COMBUSTIBLES Y COMBUSTION
PROCESOS DE COMBUSTION TEORICAS Y REAL
COMBUSTION COMPLETA
Si todo el carbono en el combustible se transforma en CO2, todo el hidrógeno se transforma en H2O y todo el azufre (si lo hay) se transforma en SO2. Esto es, todos los componentes combustibles de un combustible se queman totalmente durante un proceso de combustión completa
AIRE ESTEQUIOMETRICO O TEORICO
La cantidad mínima de aire necesaria para la combustión completa de un combustible
QUE PASA SI EL COMBUSTIBLE QUEMA POR COMPLETO CON AIRE TEORICO?
no estará presente el oxígeno sin combinar el producto de los gases
TAMBIEN SE CONOCE COMO
Cantidad de aire químicamente correcta o aire 100 por
ciento teórico.


Subtopic
COMBUSTION INCOMPLETA
Un proceso de combustión es incompleto si los productos de combustión contienen algo de combustible ,O componentes no quemados, como C, H2, CO, o bien, OH
La combustión incompleta sucede incluso cuando en
la cámara de combustión hay más oxígeno del necesario para la combustión completa. Esto puede atribuirse al mezclado insuficiente en la cámara de combustión durante el limitado tiempo en que el oxígeno y el combustible quedan en contacto.
Otra causa de combustión incompleta es la disociación, la cual se vuelve importante a elevadas temperaturas
Un proceso de combustión con cantidad de aire menor está
condenado a ser incompleto.
COMBUSTION
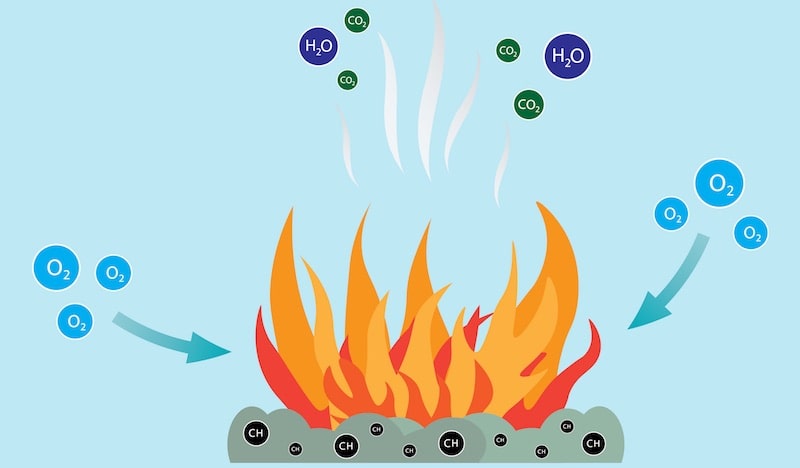
Una reacción química durante la cual se oxida un combustible y se libera
una gran cantidad de energía recibe el nombre de combustión
OXIDANTE DE LA COMBUSTION
El oxidante empleado con mayor frecuencia en los procesos de combustión es el aire, por obvias razones (es gratuito y se consigue fácilmente)
El oxígeno puro O2, se emplea como oxidante sólo en algunas aplicaciones especializadas
COMO CUALES ?
COMO la soldadura y el corte

soldadura

corte
COMO SE COMPORTA LA CONBUSTION
ENTALPIA
DE FORMACION
La entalpía de formación de un
compuesto representa la cantidad de
energía absorbida o liberada cuando el
componente se forma a partir de sus
elementos estables durante un proceso de
flujo estacionario a un estado específico
La entalpía de combustión de un combustible particular será distinta a diferentes temperaturas y presiones

Esta propiedad es la entalpía de formación h–f, la cual puede considerarse como la entalpía de una sustancia en un estado especificado debida a su composición química
La entalpía de formación de un
compuesto representa la cantidad de
energía absorbida o liberada cuando el
componente se forma a partir de sus
elementos estables durante un proceso de
flujo estacionario a un estado específico
DE COMBUSTION
En los procesos de combustión, la entalpía de reacción suele conocerse como la entalpía de combustión hC,
Es claro que la entalpía de combustión es una propiedad muy útil en el análisis de los procesos de quema de combustibles.

La entalpía de combustión representa la cantidad de energía liberada cuando un combustible se quema durante un proceso de flujo estacionario a un estado especificado.
PODER COLORIFICO
cantidad de calor liberado cuando un combustible se quema por completo en un proceso de flujo estacionario y los productos vuelven al estado de los reactivos.
ESTO ES IGUAL
el poder calorífico de un combustible es igual al valor absoluto de la entalpía de combustión del combustible
COLOR CALORIFICO = hc - KJ /KG combustible
DE QUE DEPENDE?
De de la fase del H2O en los productos. El poder
calorífico recibe el nombre de poder calorífico superior
PODER COLORIFICO INFERIOR
cuando el H2O en los productos está en
forma líquida y se llama poder calorífico inferior , cuando el H2O en los productos está en forma de vapor

la segunda ley de la termodinámica sugiere que debe existir una mejor manera de convertir la energía química en trabajo
CUAL MANERA
la menos irreversible es decir, el caso reversible. En reacciones químicas, la irreversibilidad se debe al intercambio incontrolado de electrones
entre los componentes reactivos
El intercambio de electrones puede controlarse al sustituir la cámara de combustión por celdas electrolíticas, como las
baterías de automóvil
De donde se componen la mayoría de los combustibles
HIDROGENO

CARBONO

Reciben el nombre de combustibles hidrocarburos y se denotan por la fórmula general CnHm
ETANOL
se obtiene del maíz, granos y desechos
orgánicos.

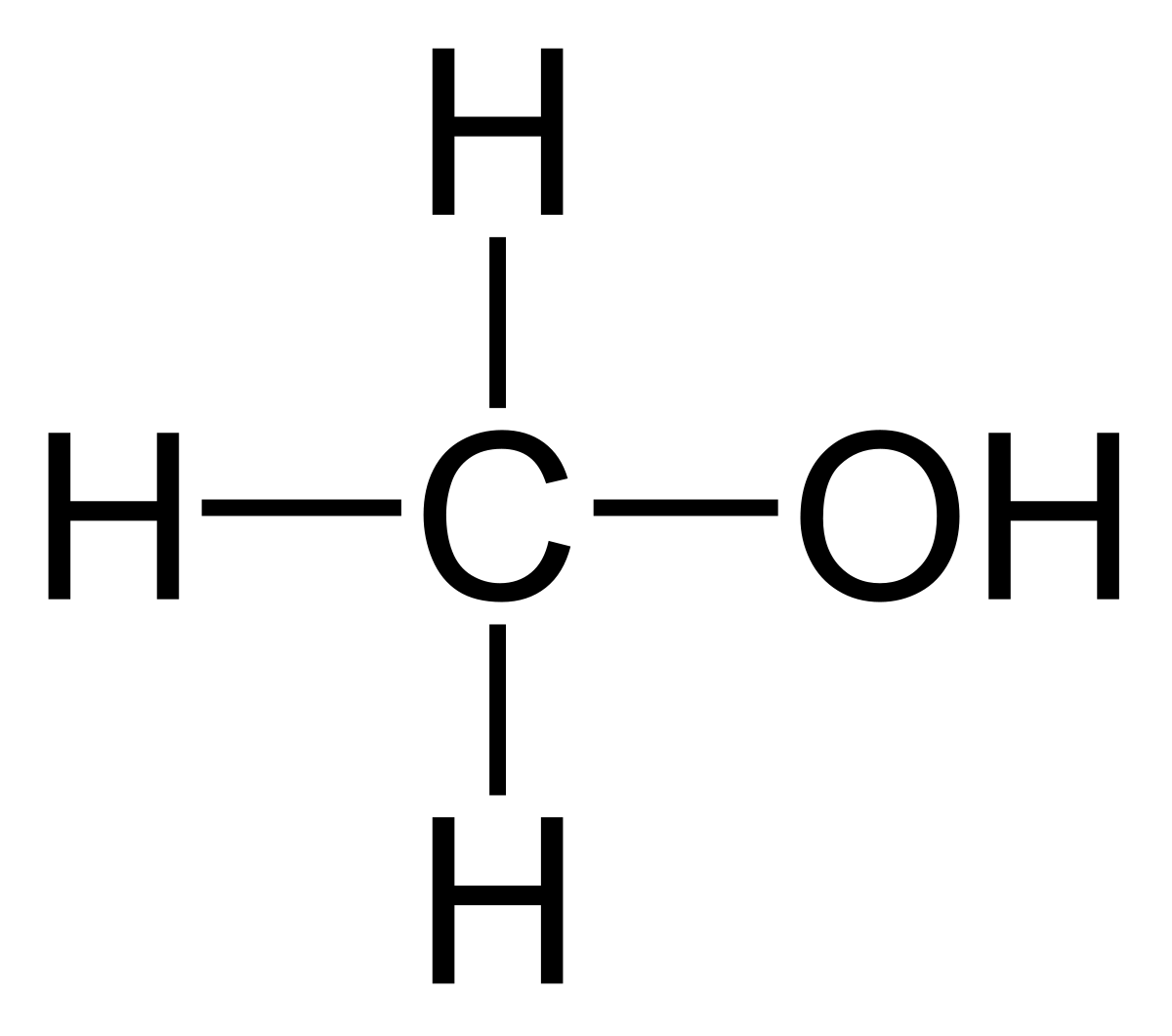
METANOL
es producido principalmente a partir del gas natural, pero también puede obtenerse a partir del carbón y de biomasa
Los combustibles hidrocarburos existen en todas las fases, y algunos son el carbón, la gasolina y el gas natural.
GAS NATURAL
LPG GAS LICUADO DE PETROLEO

subproducto del procesamiento
del gas natural o de la refinación del petróleo crudo.
CONCISTE principalmente
de propano y por lo tanto el LPG generalmente se conoce como propano
contiene pequeñas cantidades de etano, propano, hidrógeno, helio, dióxido de carbono ,nitrógeno, sulfato de hidrógeno y vapor de agua

- El gas natural es producido en pozos de gas o pozos de petróleo ricos engas natural. Principalmente está compuesto de metano.
GASOLINA
la gasolina se trata como octano C8H18
ALCOHOL ETILICO
CH3OH, al que también se le llama metanol y se usa en algunas mezclas de gasolina
La mayor parte de los combustibles hidrocarburos líquidos
son una mezcla de numerosos hidrocarburos y se obtienen del petróleo crudomediante destilación
DIESEL
dodecano, C12H26
Los hidrocarburos más volátiles se vaporizan
primero, formando lo que se conoce como gasolina. Los combustibles menosvolátiles que se obtienen durante la destilación son el queroseno, el diésel y el combustóleo
Cualquier material que puede quemarse para liberar energía recibe el nombre de combustible
TEMPERATURA DE FLAMA ADIABÁTICA
La temperatura de flama adiabática de un proceso de combustión de flujo
estacionario se determina de la ecuación al establecer Q = 0 y W= 0.
Esto H prod = H reac
La temperatura máxima encontrada en
una cámara de combustión es menor
que la temperatura de flama adiabática
teórica.
Cuanto más pequeña es la pérdida de calor, tanto mayor resulta el aumento de la temperatura. En el caso límite en que no haya pérdida de calor hacia los alrededores (Q = 0), la temperatura de los productos alcanzará un máximo, conocido como temperatura de flama adiabática o de combustión adiabática
En ausencia de cualquier interacción de trabajo y cambios cuales quiera en las energías cinética y potencial, la energía química liberada durante un proceso de combustión se pierde como calor hacia los alrededores o se usa internamente para elevar la temperatura de los productos de combustión
DE QUE DEPENDE ESTA TEMPERATURA ?
EL ESTADO DE LOS REACTIVOS
LA CANTIDAD DE AIRE UTILIZADO
EL GRADO AL QUE SE COMPLETA LA REACCION
Para un combustible especificado a un estado especificado que se quema con aire a un estado
especificado ¿QUE SUCEDE?
la temperatura de flama adiabática alcanza su valor máximo cuando sucede la combustión completa con la cantidad teórica de aire.
ANÁLISIS DE SISTEMAS REACTIVOS
CON BASE EN LA PRIMERA LEY
SISTEMAS DE FLUJOS ESTACIONARIOS
Cuando los cambios de energías cinética y potencial son insignificantes ,La relación de balance de energía para un sistema de flujo estacionario E entrada = E Salida se puede expresar para un sistema de flujo estacionario químicamente
reactivo
SISTEMAS CERRADOS

Subtopic
La relación general de balance de energía para un sistema cerrado Eentrada - Esalida = ΔE sistema se expresa para un sistema cerrado químicamente reactivo en reposo
TENER ENCUENTA
Una expresión para la energía interna de
un componente químico en términos de
la entalpía.

a establece que la entropía de una sustancia cristalina pura a la temperatura del cero absoluto es cero
La tercera ley proporciona una base común para la
entropía de todas las sustancias, y los valores de entropía relativos a esta base se denominan entropía absoluta