GASES
DEFINICIÓN
Estado de la materia
Partículas separadas
movimiento constante y aleatorio
Forma ni volumen fijo
LEYES DE LOS GASES
GRAHAM
Difusión
Los gases se mezclan y se dispersan
Efusión
Flujo de un gas a través de un orificio en un recipiente
Raiz cuadrada
Masa molar
"fórmula"
ECUACION DEL ESTADO
Comportamiento de gases ideales
Fórmula de estado
PV = nRT
P= presión
V= volumen
n= cantidad de sustancia (moles)
R= constante de los gases ideales
T= temperatura absoluta del gas
DALTON
Temperatura
Volumen constantes
Presión total de una mezcla de gases
Suma de las presiones parciales
"fórmula"
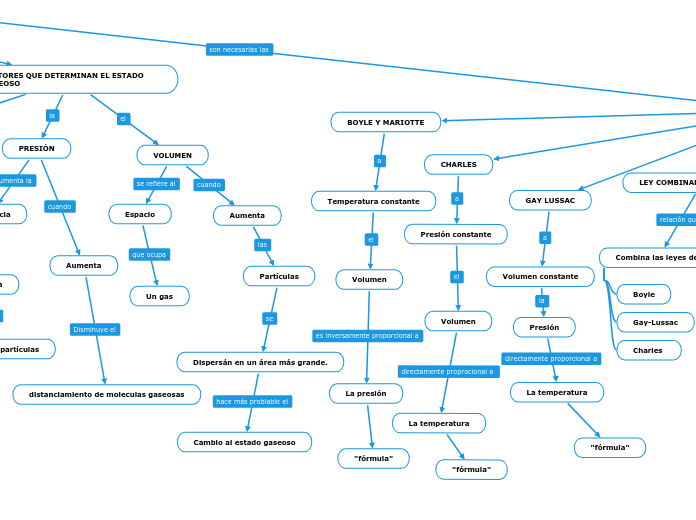
LEY COMBINADA DE LOS GASES
Combina las leyes de:
Boyle
Gay-Lussac
Charles
Ecuación
"fórmula"
Comportamiento de un gas ideal
Varía simultaneámente:
La temperatura
El volumen
La presión
GAY LUSSAC
Volumen constante
Presión
La temperatura
"fórmula"
CHARLES
Presión constante
Volumen
La temperatura
"fórmula"
BOYLE Y MARIOTTE
Temperatura constante
Volumen
La presión
"fórmula"
FACTORES QUE DETERMINAN EL ESTADO GASEOSO
VOLUMEN
Aumenta
Partículas
Dispersán en un área más grande.
Cambio al estado gaseoso
Espacio
Un gas
PRESIÓN
Aumenta
distanciamiento de moleculas gaseosas
frecuencia
fuerza
choques de las partículas
TEMPERATURA
Aumenta
Energía cinética
moleculas gaseosas
El cambio de estado
Movimiento más rápido
TEORÍA CINÉTICA
Relación entre:
propiedades de los gases
energía cinética
Partículas en movimiento
pequeñas (átomos o moléculas)
Energía cinética
La temperatura