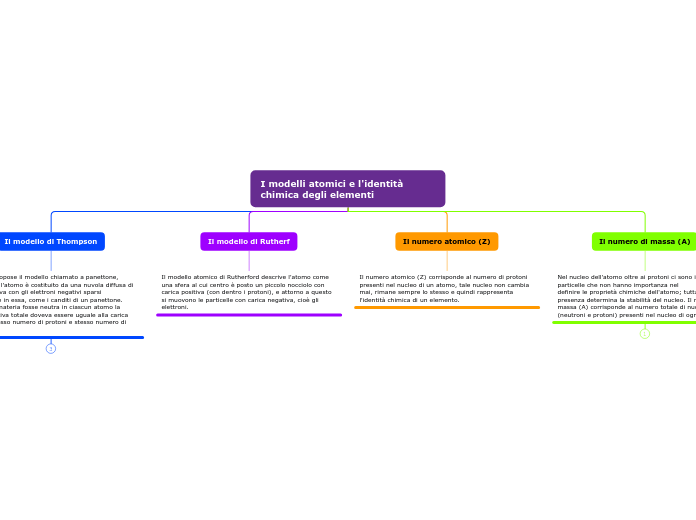
I modelli atomici e l'identità chimica degli elementi
Il modello di Thompson
Thomson propose il modello chiamato a panettone, secondo cui l'atomo è costituito da una nuvola diffusa di carica positiva con gli elettroni negativi sparsi casualmente in essa, come i canditi di un panettone. Affinché la materia fosse neutra in ciascun atomo la carica negativa totale doveva essere uguale alla carica positiva (stesso numero di protoni e stesso numero di elettroni).
Il modello di Rutherf
Il modello atomico di Rutherford descrive l'atomo come una sfera al cui centro è posto un piccolo nocciolo con carica positiva (con dentro i protoni), e attorno a questo si muovono le particelle con carica negativa, cioè gli elettroni.
Il numero atomico (Z)
Il numero atomico (Z) corrisponde al numero di protoni presenti nel nucleo di un atomo, tale nucleo non cambia mai, rimane sempre lo stesso e quindi rappresenta l'identità chimica di un elemento.
Il numero di massa (A)
Nel nucleo dell'atomo oltre ai protoni ci sono i neutroni, particelle che non hanno importanza nel
definire le proprietà chimiche dell'atomo; tuttavia la loro presenza determina la stabilità del nucleo. Il numero di massa (A) corrisponde al numero totale di nucleoni (neutroni e protoni) presenti nel nucleo di ogni atomo.