Ionenbindungen
2.Entstehung
Ionenbindungen entstehen zwischen Elementen mit einer hohen Elektronegativitatsdifferenz. Dabei handelt es sich um ein Nichtmetall und ein Metall.
3.Eigenchaften
hohe Schmelztemperatur und Sidetemperatur
gut im Wasser loslich
leiten in Wasser gelost oder als Schmelze den elektrischen Strom
sind als kristalline Feststoffe elektrische Nichtleiter/ Isolatoren
4.Beispiele
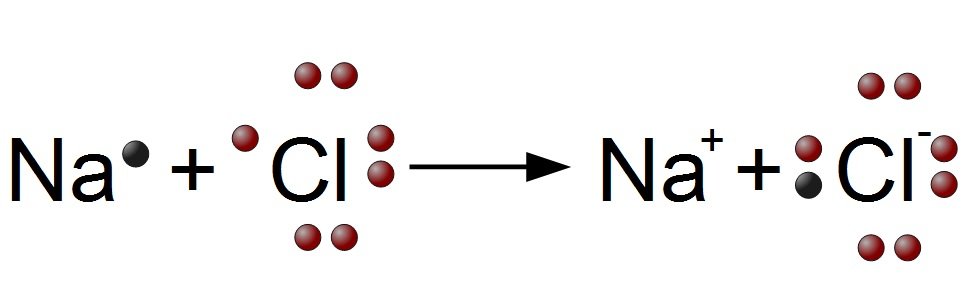
Natriumchlorid:
Magnesiumbromid: MgBr2
Bemerkung!: Die meisten Ionenbindungen sind Salze.
1.Definition
Die ionische Bindung ist eine chemische Bindung, die auf der elektrostatischen Anziehung positiv und negativ geladener Ionen basiert.
6.Ionenkristal
Under einem Ionenkristal oder Ionengitter versteht man die regelmassige raumliche Anordnung von Anionen und Kationen eines homogenen Stoffes im festen Zustand. Der Zusamenhalt des Gitterverbandes erfolgt durch die Ionenbindung.
5.Anionen und Kationen
Anionen: ist ein negativ geladenes Ion. Da negativ geladene Ionen bei einer Elektrolyse zur Anode (dem + Pol) wandern, wurde fur sie der Name Anion gewahlt.
Kationen: ist ein positiv geladenes Ion. Da positiv geladene Ionen bei einer Elektrolyse zur Kathode (dem - Pol) wandern, wurde fur sie der Name Kationen gewahlt.