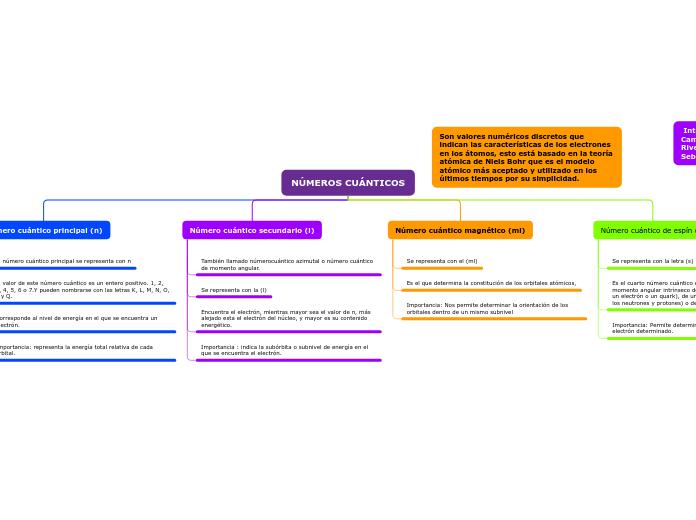
NÚMEROS CUÁNTICOS
Número cuántico principal (n)
El número cuántico principal se representa con n
El valor de este número cuántico es un entero positivo. 1, 2, 3, 4, 5, 6 o 7.Y pueden nombrarse con las letras K, L, M, N, O, P y Q.
Corresponde al nivel de energía en el que se encuentra un electrón.
Importancia: representa la energía total relativa de cada orbital.
Número cuántico secundario (l)
También llamado númerocuántico azimutal o número cuántico de momento angular.
Se representa con la (l)
Encuentra el electrón, mientras mayor sea el valor de n, más alejado esta el electrón del núcleo, y mayor es su contenido energético.
Importancia : indica la subórbita o subnivel de energía en el que se encuentra el electrón.
Número cuántico magnético (ml)
Se representa con el (ml)
Es el que determina la constitución de los orbitales atómicos,
Importancia: Nos permite determinar la orientación de los orbitales dentro de un mismo subnivel
Número cuántico de espín (s)
Se representa con la letra (s)
Es el cuarto número cuántico e indica la orientación del momento angular intrínseco de una partícula elemental (como un electrón o un quark), de una partícula compuesta (como los neutrones y protones) o de un núcleo atómico entero.
Importancia: Permite determinar el sentido de giro de un electrón determinado.