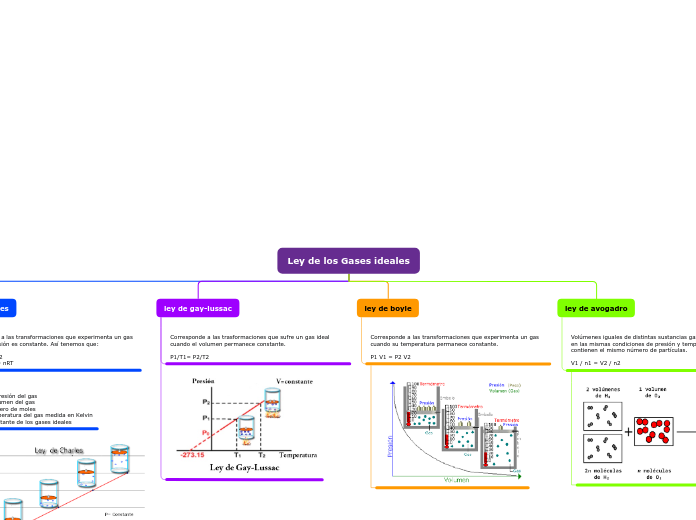
Ley de los Gases ideales
ley de charles
Corresponden a las transformaciones que experimenta un gas cuando la presión es constante. Así tenemos que:
V1/T1 = V2/T2
Formula: PV = nRT
Donde:
P= es la presión del gas
V = el volumen del gas
n= el número de moles
T= la temperatura del gas medida en Kelvin
R= la constante de los gases ideales

ley de gay-lussac
Corresponde a las trasformaciones que sufre un gas ideal cuando el volumen permanece constante.
P1/T1= P2/T2

ley de boyle
Corresponde a las transformaciones que experimenta un gas cuando su temperatura permanece constante.
P1 V1 = P2 V2

ley de avogadro
Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de partículas.
V1 / n1 = V2 / n2