Teoría cuántica y estructura atómica
Radiactividad
La radiactividad es un fenómeno natural por el cual ciertos átomos cambian su estructura. La comprensión de este fenómeno ha permitido su aplicación en
diferentes actividades.
En este proceso, los núcleos de los átomos de los elementos se desintegran, con formación de nuevos núcleos que corresponden a nuevos elementos y liberación de energía. Se puede dividir en 2 categorías según su origen.
Por un lado tenemos la radioactividad natural que es el proceso mediante el cual los núcleos pesados e inestables de algunos materiales radiactivos se desintegran de forma espontánea y producen nuevos núcleos de nuevos elementos y liberación de energía.
Por otro lado, la radioactividad artificial que consiste en la ruptura de los núcleos de átomos estables a través del bombardeo con partículas ligeras aceleradas, dando origen a nuevos núcleos que corresponden a nuevos elementos.
Radiación alfa: si un núcleo es radioactivo "alfa" va a decaer por la expulsión de
una "partícula alfa" compuesta por dos neutrones y dos protones. Como resultado
de la pérdida de dos protones el átomo cambiará a un elemento diferente que tiene
un número atómico dos valores hacia abajo. La radiación alfa tiene lugar
normalmente en los elementos pesados.
Radiación beta: en el decaimiento "beta", un neutrón se convierte en un protón (o
viceversa) y una partícula beta es expulsada para mantener el balance de cargas
eléctricas y liberar el exceso de energía. El átomo se convierte en un elemento un
número más alto o más bajo en la serie progresiva.
Radiación gamma: la emisión de partículas alfa y beta no siempre dejan al núcleo
en su estado más estable y el exceso de energía remanente puede ser liberada
como rayos gamma (en forma de radiación electromagnética, como lo son los rayos
X o las microondas)
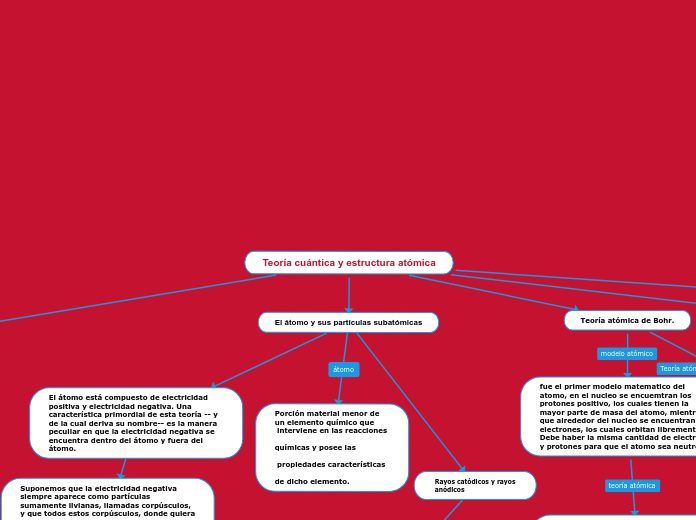
Teoría atómica de Bohr.
El físico alemán Arnold Sommerfeld (1868-1951) completó este modelo atómico de Bohr considerando que las órbitas descritas no eran circulares, sino elípticas.
En 1916, Sommerfeld perfeccionó el modelo atómico de Bohr intentando paliar los dos principales defectos de éste. Para eso introdujo dos modificaciones básicas: Órbitas casi-elípticas para los electrones y velocidades relativistas.
Las órbitas con:
l = 0 se denominarían posteriormente orbitales "s" o Sharp
l = 1 se denominarían "p" o principal.
l = 2 se denominarían "d" o diffuse.
l = 3 se denominarían "f" o fundamental.
fue el primer modelo matematico del atomo, en el nucleo se encuemtran los protones positivo, los cuales tienen la mayor parte de masa del atomo, mientras que alrededor del nucleo se encuentran los electrones, los cuales orbitan libremente. Debe haber la misma cantidad de electrones y protones para que el atomo sea neutro
Los electrones siguen girando alrededor del núcleo, pero en niveles específicos, los cuales están cuantizados y permiten al electrón girar sin perder o ganar energía.. Si el electrón baja de nivel, deberá liberar la misma cantidad de energía.
Sí se le entrega energía al electrón, éste puede saltar a un nivel superior
Si el electrón baja de nivel, deberá liberar la misma cantidad de energía.
Teoría cuántica
El principio de la dualidad descansa sobre el efecto fotoeléctrico, el cual plantea que la luz puede comportarse de dos maneras según las circunstancias:
1.- Luz como una Onda: esta es usada en la física clásica, sobre todo en óptica, donde los lentes y los espectros visibles requieres de su estudio a través de las propiedades de las ondas.
2.- Luz como Partícula: Usada sobre todo en física cuántica, según los estudios de Planck sobre la radiación del cuerpo negro, la materia absorbe energía electromagnética y luego la libera en forma de pequeños paquetes llamados fotones, estos cuantos de luz, tienen de igual manera una frecuencia, pero gracias a éstos, se pueden estudiar las propiedades del átomo.
La función de onda en sí misma no tiene significado físico real directo. Sin embargo el cuadrado de la función de la onda, Ψ, está relacionado con la probabilidad de encontrar al electrón en cierta región del espacio.
El principio de incertidumbre fue descubierto por Heisenberg en 1927 y es fundamental en física cuántica. Establece que ΔpΔx ≥ h donde Δp es la incertidumbre en conocer el momento de la partícula (momento igual a masa por velocidad), Δx es la incertidumbre en conocer la posición de la partícula y h es la constante de Planck (h=6.63×10⁻³⁴Js).
Subtopic
La función de onda en sí misma no tiene significado físico real directo. Sin embargo el cuadrado de la función de la onda, Ψ, está relacionado con la probabilidad de encontrar al electrón en cierta región del espacio.
Números cuánticos y
orbitales atómicos.
Principal :se representa con la letra(n) determina el nivel de energía
Secundario también conocido como azimutal ,Se representa con la letra (l) , determina la forma del orbital ,una órbita soporta máximo 2 electrones
Magnético Se representa por la letra (m) determina la orientación del orbital en el espacio
spin se representa por la letra s ,relaciona el giro del electrón sus valores son -1/2 y +1/2
orbital S Números cuánticos del orbital s: l=0 y m=0
Por lo tanto existe 1 orbital s por cada capa o nivel de energía (n)
El orbital s tiene forma esférica
El orbital s aumenta de tamaño con el nivel de energía (n)
Cada orbital s puede contener hasta un máximo de 2 electrones
El orbital p
Números cuánticos del orbital p: l=1 y m= -1,0,+1
Por lo tanto existen 3 orbitales p por cada capa o nivel de energía (n)
Los orbitales p tienen forma de parejas de lóbulos que están orientados en cada uno de los 3 ejes (x, y, z)
Cada pareja de lóbulos puede contener 2 electrones, por lo que en total, el orbital p puede contener un máximo de 6 electrones.
Orbital d
Números cuánticos del orbital d:
l = 2
m = -2,-1,0,+1,+2
Por lo tanto existen 5 orbitales d por cada capa o nivel de energía (n).
Los orbitales d tienen formas diversas formadas por catro grupos de cuatro lóbulos cada uno, y un último formado por una pareja de lóbulos rodeada por un anillo.
Cada uno de los 5 suborbitales d puede contener 2 electrones.
Por lo tanto, el orbital p puede contener un máximo de 10 electrones.
Orbital f
Números cuánticos del orbital f: l=3 y m= -3,-2,-1,0,+1,+2,+3
Por lo tanto existen 7 orbitales f por cada capa o nivel de energía (n).
Los orbitales f tienen formas diversas formadas por grupos lobulares y anillos.
Cada uno de los 7 suborbitales d puede contener 2 electrones, por lo que en total, el orbital p puede contener un máximo de 14 electrones.
Distribución electrónica en sistemas
poli electrónicos.
Para llenar los orbitales correctamente, siga la dirección de la flecha tal como se muestra en la gráfica. Primero 1s, luego 2s, después sube a 2p y baja 3s, 3p y baja a 4s. En este punto, el siguiente nivel de energía más bajo no es 4p, sino que sube a 3d para luego bajar a 4p y 5s. Y así, sucesivamente.Se le llama la regla del serrucho, debido a la acción de subir y bajar del modo descrito: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 6f 7s 7p 7d 7
Este principio de la cuántica dice que dos partículas ( concretamente fermiones) que tiene los números cuánticos con los que constan idénticos, no pueden existir.
Esto significa que dos electrones ( fermiones) que se encuentren en un átomo no podrán poseer a la vez iguales números cuánticos.
La Configuración o Distribución electrónica nos dice como están ordenados los electrones en los distintos niveles de energía (órbitas), o lo que es lo mismo como están distribuidos los electrones alrededor del núcleo de su átomo.
TABLA PERIODICA
En la tabla periódica los elementos están colocados secuencialmente, esto es, por orden creciente de su número atómico. Además, elementos con comportamiento químico similar se sitúan en la misma columna. Las filas y columnas de la tabla periódica de los elementos reciben un nombre específico con el que nos referiremos siempre a ellos:
Grupos: son las columnas verticales de la tabla. Reciben este nombre por agrupar elementos de propiedades químicas similares.
Periodos: son las filas horizontales de la tabla. Dentro de un periodo, los elementos están ordenados por número atómico creciente.
Si dos o más electrones de un mismo átomo tienen los mismos valores en sus números cuánticos principales ( n ) y en sus números cuánticos secundarios ( l ) , entonces tendrán iguales valores de spin ( s ) siempre y cuando no se trasgreda el principio de exclusión (de Pauli). Para aquellos que no pueden entender tanta palabrería pueden tomarlo así: El principio del microbús (guagua, micro, bus o algún otro nombre que tenga el transporte colectivo en tu país) Las personas (electrones) que se suban a un microbús (nº cuántico principal) tienden a sentarse en los asientos desocupados (nº cuántico magnético) de la fila más cercana a la puerta (nº cuántico secundario) antes que sentarse más al final, compartir un asiento (nº cuántico spin = +1/2), o subirse a otro microbús.