arabera Kupickk Kupickk 4 years ago
335
Create strategy from SWOT analysis
arabera Kupickk Kupickk 4 years ago
335

Honelako gehiago
Enter your organization name
Type in the organization or area that is the subject of this analysis. You might find it helpful to add the date for reference so that you can review changes at a later date.
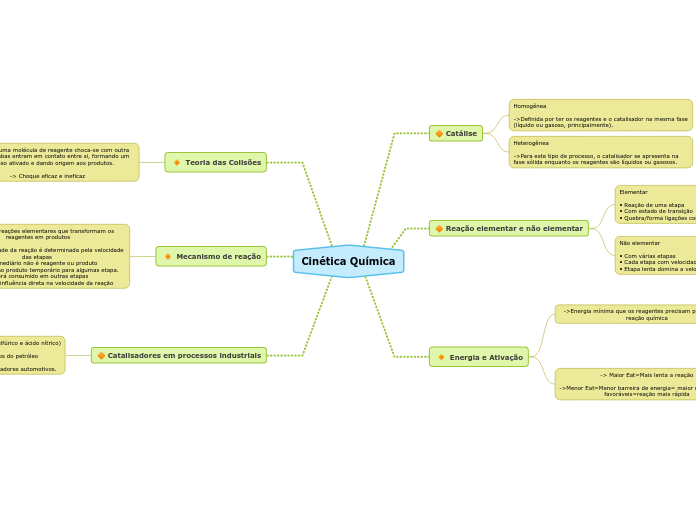
- Se inicia no final da Lenta - Menor energia de ativação - 2° etapa da reação
- Determinante de velocidade - 1° etapa da reação - Mesma lei de velocidade que a lei determinada experimentalmente.
Add a survival strategy
Review each of the highest-ranked weaknesses facing your organisation, and compare them with each of the highest-ranked threats.
For example, if a strong competitor is a threat, and unhappy customers are a weakness, then your customers might simply move to your competitor. A survival strategy would be to work on improving customer satisfaction, not as a side-effect of doing something else, but as a direct action. Otherwise, the survival of your organisation might be at risk.