arabera Aurora Anaid García Martínez 4 years ago
522
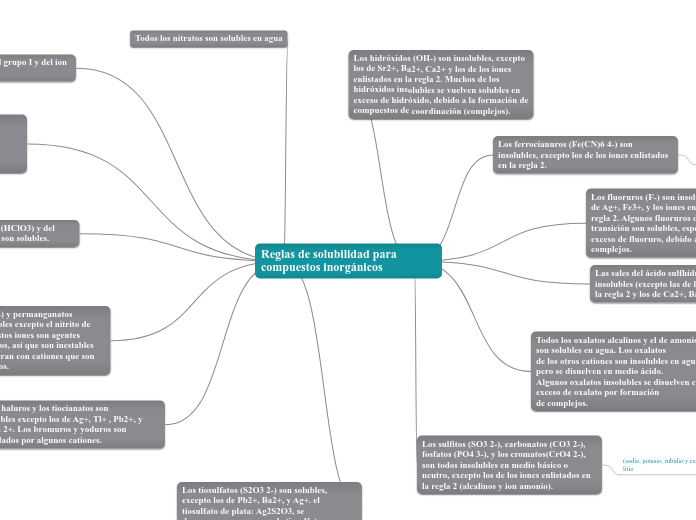
Reglas de solubilidad para compuestos inorgánicos
arabera Aurora Anaid García Martínez 4 years ago
522

Honelako gehiago