arabera Alexziz Soc 4 years ago
413
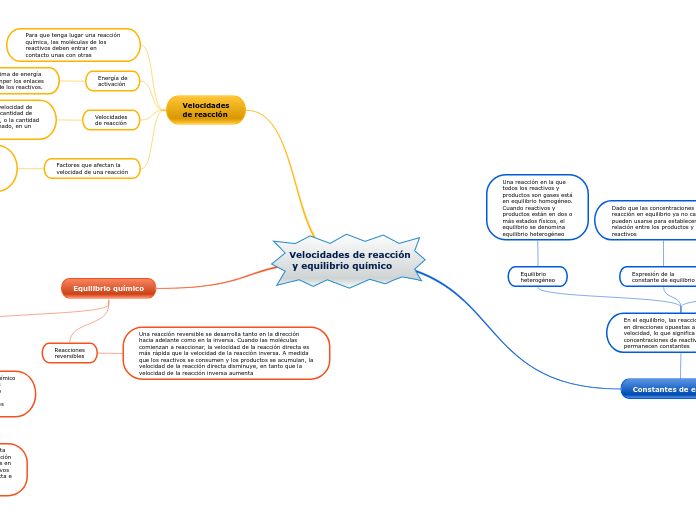
Velocidades de reacción y equilibrio químico
arabera Alexziz Soc 4 years ago
413

Honelako gehiago
La velocidad de la reacción directa es igual a la velocidad de la reacción inversa. No ocurren más cambios en las concentraciones de los reactivos o productos; las reacciones directa e inversa continúan a velocidades iguales.
El valor numérico de la constante de equilibrio se calcula a partir de la expresión de la constante de equilibrio, al sustituir en la expresión las concentraciones de los reactivos y los productos en equilibrio medidas experimentalmente
Dado que las concentraciones en una reacción en equilibrio ya no cambian, pueden usarse para establecer una relación entre los productos y los reactivos
Una reacción en la que todos los reactivos y productos son gases está en equilibrio homogéneo. Cuando reactivos y productos están en dos o más estados físicos, el equilibrio se denomina equilibrio heterogéneo