1/1. Как наиболее точно подсчитать количество инфузорий?
2019, Валерий Зайцев. Это произведение доступно по лицензии Creative Commons Attribution-NonCommercial («Атрибуция — Некоммерческое использование») 4.0 Всемирная
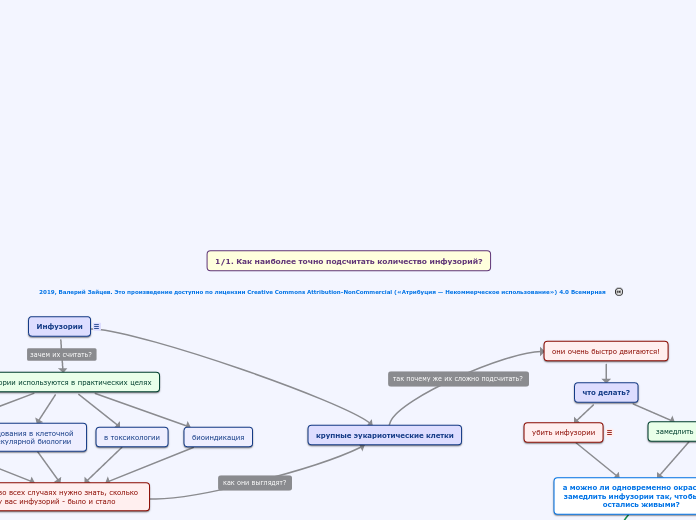
Инфузории
Одна из наиболее широко применяемых в отечественных исследованиях сред для выращивания инфузорий рода Paramecium - среда Лозино-Лозинского.Обычно она готовится в виде концентрата 10-кратной концентрации (10x). Концентрат среды Лозина-Лозинского готовится следующим образом: в 1 литре дистиллированной воды растворяют 0,1 г NaCl, 0,01 г KCl, 0,2 г NaHCO3, 0,01 г MgSO4 х 7 H2O, 0,01 г CaCl2. Для приготовления рабочего раствора (инкубационной смеси) смешивают 1 объем концентрата с 9 объемами воды (например, 100 мл концентрата + 900 мл воды).Культура парамеций лучше всего выращивать при температуре 20-25˚C с естественной рассеянной освещенностью в течении дня или с искусственным чередованием света и темноты («день-ночь») 12 + 12 часов в течение суток.В качестве корма можно использовать множество веществ и продуктов, но одним из самых простых, доступных и легко стандартизируемых вариантов являются обычные сухие пекарские дрожжи. Активные (быстрорастворимые) дрожжи лучше, чем те, которые требуют предварительной инкубации в жидкости. Рекомендуемый режим кормления 0,07 г сухих дрожжей на культуру объемом 400-600 мл 2 раза в неделю. Перед добавлением в культуру дрожжи суспендируются в 10 мл воды для более равномерного распределения в культуре.Через каждые 1-2 недели культуру инфузорий требуется отмывать от остатков корма и продуктов метаболизма. Для этого культуру инфузорий переливают в узкогорлую колбу, которую накрывают темной тканью, оставляя открытым горлышко. Средой Лозино-Лозинского доводят до верха. Через некоторое время инфузории выплывают в верхнюю часть колбы, после чего их отбирают дозатором на 10 мл и переносят в чистый стакан, а затем снова доливают средой Лозино-Лозинского. Процедура повторяется до тех пор, пока культура не станет прозрачной. После отмывки инфузории необходимо покормить, а на сосуд с ними поставить дату последней отмывки.
инфузории используются в практических целях
корм для рыб
исследования в клеточной и молекулярной биологии
в токсикологии
биоиндикация
Лабораторная работа 1/1
результаты обучения
развиваемые навыки
формулировать научную гипотезу для последующей экспериментальной проверки
вопросы для обсуждения
Почему обработка йодом приводит к практически мгновенной гибели инфузорий?Каков может быть механизм снижения подвижности инфузорий под действием изопропанола и других соединений, для которых экспериментально установлен замедляющий эффект?Почему инфузории плохо прокрашиваются одними красителями и легко - другими?Почему при действии некоторыми красителями наблюдается постепенное снижение подвижности инфузорий?
лабораторные протоколы
организация работы
Подготовительная часть (преподаватель + лаборант): подготовка необходимых материалов и оборудования.Подготовительная часть (лаборант): поддержание культуры инфузорий Paramecium caudatum в среде Лозино-Лозинского при температуре 25°С.Основная часть (студенты на занятии): каждый из студентов окрашивает инфузории йодом; каждый из студентов сначала выполняет работу с одинаковым замедлителем движения инфузорий (изопропанол), для следующего опыта каждый из студентов выбирает одно из предложенных преподавателем соединений, предполагая, что оно тоже будет замедлять движение инфузорий. Желательно, чтобы у всех студентов в группе были разные соединения для второго опыта. Затем каждый из студентов окрашивает инфузории по крайней мере одним из красителей из предложенных преподавателем. По результатам окрашивания инфузорий различными красителями делается один вывод на всю группу.Важно! Поскольку студенты работают с разными условиями экспериментов преподавателю следует обеспечить студентам возможность ознакомиться с результатами друг друга. Делать это в ходе выполнения эксперимента или во время заключительного мини-коллоквиума занятия - выбор преподавателя.
1/1 а. Летальное окрашивание инфузорий
Протокол выполнения опытаКраситель: аптечный раствор йода, разбавленный водой в соотношении 1:10.Важно! не допускайте пересыхания капли с инфузориями в ходе работы; при необходимости добавляйте к капле на предметном стекле небольшие количества среды Лозино-ЛозинскогоХод выполненияподготовьте предметное стекло для работы, обезжирив его изопропанолом;отберите из сосуда с культурой инфузорий небольшую аликвоту, используя пастеровскую или глазную пипетку, стараясь, чтобы в отобранный объем жидкости попало по крайней мере несколько инфузорий;нанесите каплю культуры на предметное стекло таким образом, чтобы в капле были видны хотя бы несколько инфузорий;нанесите на предметное стекло рядом с культурой инфузорий каплю раствора исследуемого вещества;соедините капли между собой, подождите 5 минут;подсчитайте количество инфузорий с помощью лупы (увеличение от 2 до 10х) и под бинокулярным микроскопом (увеличение 4-20х).
1/1 б. Исследование влияния веществ на подвижность инфузорий
Протокол выполнения единичного опытаИсследуемые вещества: (1) изопропанол (в форме 50% водного раствора); (2) вещество, самостоятельно и обоснованно выбранное студентом из предложенных преподавателем.Важно! не допускайте пересыхания капли с инфузориями в ходе работы; при необходимости добавляйте к капле на предметном стекле небольшие количества среды Лозино-ЛозинскогоХод выполненияподготовьте предметное стекло для работы, обезжирив его изопропанолом;отберите из сосуда с культурой инфузорий небольшую аликвоту, используя пастеровскую или глазную пипетку, стараясь, чтобы в отобранный объем жидкости попало по крайней мере несколько инфузорий;нанесите каплю культуры на предметное стекло таким образом, чтобы в капле были видны хотя бы несколько инфузорий;изучите поведение инфузорий невооруженным взглядм, с помощью лупы (увеличение от 2 до 10х) и под бинокулярными микроскопом (увеличение 4-20х);нанесите на предметное стекло рядом с культурой инфузорий каплю раствора исследуемого вещества;соедините капли между собой, наблюдайте изменения в поведении инфузорий.Проведите опыт с двумя исследуемыми веществами в форме водных растворов.
1/1 в. Изучение эффекта красителей на подвижность и выживаемость инфузорий
Протокол выполнения опытаКрасители: предлагаются преподавателем в виде водных растворов различной концентрации. Примеры красителей, которые могут быть использованы в работе: нейтральный красный, конго красный, метиловый зеленый, кристаллический фиолетовый, метиленовый голубой, тартразин, бриллиантовый синий FCF, сансет желтый FCF, ализариновый красный С, родамин Ж, родамин С, понсо 4R (Е124), метиловый красный.Важно! не допускайте пересыхания капли с инфузориями в ходе работы; при необходимости добавляйте к капле на предметном стекле небольшие количества среды Лозино-ЛозинскогоХод выполненияподготовьте предметное стекло для работы, обезжирив его изопропанолом;отберите из сосуда с культурой инфузорий небольшую аликвоту, используя пастеровскую или глазную пипетку, стараясь, чтобы в отобранный объем жидкости попало по крайней мере несколько инфузорий;нанесите каплю культуры на предметное стекло таким образом, чтобы в капле были видны хотя бы несколько инфузорий;нанесите на предметное стекло рядом с культурой инфузорий каплю раствора исследуемого вещества;соедините капли между собой, подождите 5 минут;изучите поведение инфузорий невооруженным взглядм, с помощью лупы (увеличение от 2 до 10х) и под бинокулярными микроскопом (увеличение 4-20х);оцените прокрашивание инфузорий, степень изменения подвижности, траекторию их движения;переставьте предметное стекло с покрашенными инфузориями в микроскоп и рассмотрите внутриклеточную структуру окрашенных клеток.
оформление результатов
Выполняется внеаудиторно. Загружается дистанционно для оценки преподавателем с использованием выбранного формата интерактивного общения (LMS, облачное файлохранилище, социальные сети, онлайн-сервисы организации совместной работы и т.д.).
1/1 а - описательное
В форме эссе в свободной форме, обязательно отражающем:цель экспериментов,проверяемую научную гипотезу (формулируется самим студентом),протокол экспериментов,результаты эксперимента по окрашиванию инфузорий йодом,общий вывод с указанием, удалось ли подтвердить проверяемую научную гипотезу.Эссе рекомендуется сопровождать изображениями и / или видеофайлами, полученными в ходе экспериментов.
1/1 б - описательное
В форме эссе в свободной форме, обязательно отражающем:цель экспериментов,проверяемую научную гипотезу (формулируется самим студентом),протокол экспериментов,результаты эксперимента с эталонным веществом (изопропанол),вывод из эксперимента с изопропанолом,обоснование выбора второго вещества для эксперимента,результаты эксперимента с веществом, выбранным студентом,общий вывод с указанием, удалось ли подтвердить проверяемую научную гипотезу.Эссе рекомендуется сопровождать изображениями и / или видеофайлами, полученными в ходе экспериментов.
1/1 в - описательное
В форме эссе в свободной форме, обязательно отражающем:цель экспериментов,проверяемую научную гипотезу (формулируется самим студентом),протокол экспериментов,результаты экспериментов с проверяемыми красителями,сравнительный анализ результатов окрашивания инфузорий разными красителями,общий вывод с учетом результатов всех студентов в группе с указанием, удалось ли подтвердить проверяемую научную гипотезу.Эссе рекомендуется сопровождать изображениями и / или видеофайлами, полученными в ходе экспериментов.
Статьи для чтения
Hall, Katz, 2011
Hall M.S., Katz L.A. On the nature of species: insights from Paramecium and other ciliates. Genetica. 2011; 139(5): 677–684. doi: 10.1007/s10709-011-9571-3
во всех случаях нужно знать, сколько у вас инфузорий - было и стало
крупные эукариотические клетки
они очень быстро двигаются!
что делать?
замедлить инфузории!
Достоинства:медленно двигающиеся или остановившиеся клетки инфузорий гораздо легче обнаружить и посчитатьинфузории остаются живыми, поэтому их можно вернуть в культуру и изучать дальшеНедостатки:клетки остаются полупрозрачными неокрашенными, поэтому подсчет может оказаться недостаточно точным
физически
добавление в культуру инфузорий субстанций / объектов, физически мешающих свободному и быстрому перемещению инфузорий
химически
добавить химические вещества, которые снижают подвижность инфузорий или парализуют их, но не вызывают их гибели
убить инфузории
Достоинства:окрашивание полупрозрачных клеток инфузорий сильно облегчает их подсчетНедостатки:инфузории погибают, дальнейшие опыты с ними невозможны