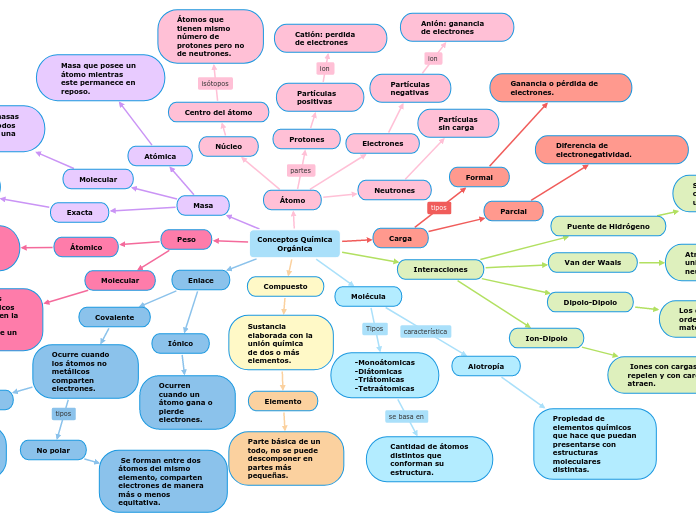
Conceptos Química Orgánica
Compuesto
Elemento
Parte básica de un todo, no se puede descomponer en partes más pequeñas.
Átomo
Núcleo
Centro del átomo
Átomos que tienen mismo número de protones pero no de neutrones.
Protones
Partículas positivas
Catión: perdida de electrones
Electrones
Partículas negativas
Anión: ganancia de electrones
Neutrones
Partículas sin carga
Molécula
Alotropía
Propiedad de elementos químicos que hace que puedan presentarse con estructuras moleculares distintas.
-Monoátomicas
-Diátomicas
-Triátomicas
-Tetraátomicas
Cantidad de átomos distintos que conforman su estructura.
Peso
Molecular
Suma de los pesos atómicos que entran en la fórmula molecular de un compuesto.
Átomico
Valor promedio del peso de los isotopos que conforman un elemento químico.
Masa
Atómica
Molecular
Exacta
Masa de una sustancia por unidad de cantidad de sustancia.
Carga
Formal
Ganancia o pérdida de electrones.
Parcial
Diferencia de electronegatividad.
Interacciones
Puente de Hidrógeno
Se forman entre un hidrógeno con una carga parcial positiva y un átomo más electronegativo.
Van der Waals
Atracciones débiles que mantienen unidas a moléculas eléctricamente neutras.
Dipolo-Dipolo
Los dipolos se atraen entre si y el ordenamiento extiende todo el material.
Ion-Dipolo
Iones con cargas iguales se repelen y con cargas distintas se atraen.
Enlace
Covalente
Ocurre cuando los átomos no metálicos comparten electrones.
Polar
Electrones se comparten de forma no equitativa, pasan más tiempo cerca de un átomo que del otro.
No polar
Se forman entre dos átomos del mismo elemento, comparten electrones de manera más o menos equitativa.
Iónico
Ocurren cuando un átomo gana o pierde electrones.