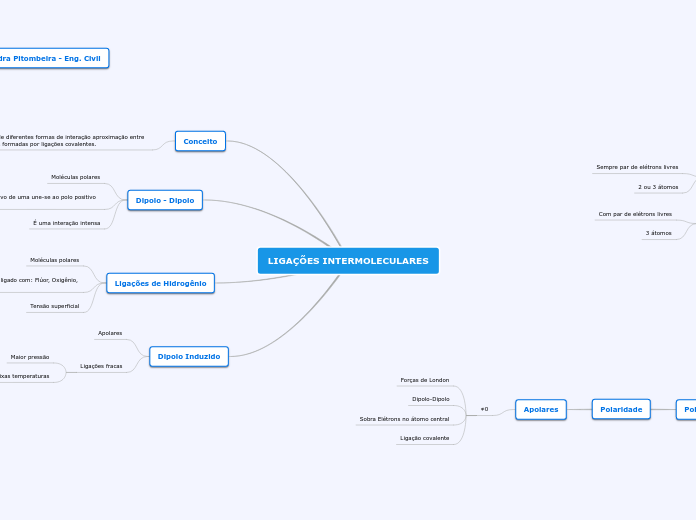
LIGAÇÕES INTERMOLECULARES
Conceito
Trata-se de diferentes formas de interação aproximação entre moléculas formadas por ligações covalentes.
Apolares
Polares
Dipolo - Dipolo
Moléculas polares
Interagem com polo negativo de uma une-se ao polo positivo da outra.
É uma interação intensa
Ligações de Hidrogênio
Moléculas polares
Ligações onde o hidrogênio esteja ligado com: Flúor, Oxigênio, Nitrogênio.
H+ -> F.O.N
Tensão superficial
Dipolo Induzido
Apolares
Ligações fracas
Maior pressão
Baixas temperaturas
Polaridade
Polares
=0
H -> F.O.N
Sim
Ligação de Hidrogênio
Não
Dipolo-Dipolo ou Dipolo - induzido
Não sobra elétrons no átomo central
Ligação Ionica
Sempre polar
Ligação Covalente
Apolares
≠0
Forças de London
Dipolo-Dipolo
Sobra Elétrons no átomo central
Ligação covalente
Geometria Molecular
Trigonal Plana
Sem par de elétrons livres
4 átomos
Piramidal
Com par de elétrons livres
4 átomos
Tetraédrica
5 átomos
Linear
Sempre par de elétrons livres
2 ou 3 átomos
Angular
Com par de elétrons livres
3 átomos