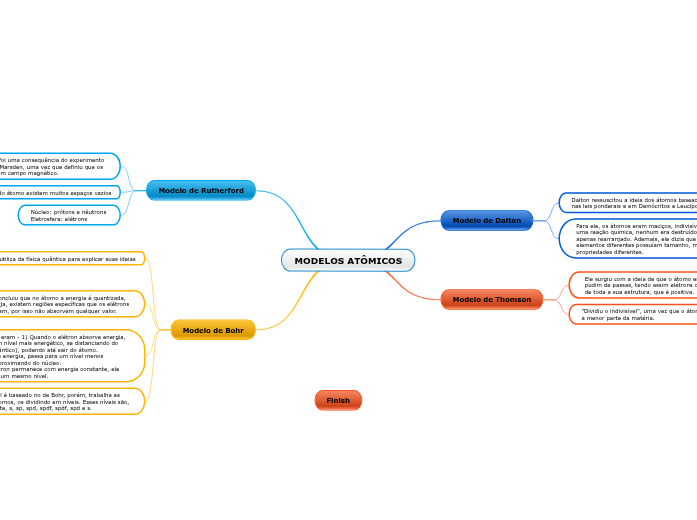
MODELOS ATÔMICOS
Modelo de Dalton
Dalton ressuscitou a ideia dos átomos baseados
nas leis ponderais e em Demócritos e Leucipo.
Para ele, os átomos eram maciços, indivisíveis e durante
uma reação química, nenhum era destruído ou formado, apenas rearranjado. Ademais, ele dizia que átomos de elementos diferentes possuíam tamanho, massa e propriedades diferentes.
Modelo de Thomson
Ele surgiu com a ideia de que o átomo era semelhante a um
pudim de passas, tendo assim elétrons distribuídos ao longo de toda a sua estrutura, que é positiva.
"Dividiu o indivisível", uma vez que o átomo não é mais
a menor parte da matéria.
Modelo de Rutherford
Seu modelo foi uma consequência do experimento
de Geigen e Marsden, uma vez que definiu que os
átomos tinham campo magnético.
Dentro do átomo existem muitos espaços vazios
Núcleo: prótons e nêutrons
Eletrosfera: elétrons
Modelo de Bohr
Ele utiliza da física quântica para explicar suas ideias
Por meio de um experimento,
ele descobre que o modelo
antigo estava errado, uma vez
que o espectro que saiu do prisma
não foi contínuo.
Ele concluiu que no átomo a energia é quantizada,
ou seja, existem regiões específicas que os elétrons
ocupam, por isso não absorvem qualquer valor.
Nível fundamental: Nível de energia
que o elemento encontra naturalmente
preenchido.
Nível excitado: Quando o nível é maior
que o natural.
Seus postulados eram - 1) Quando o elétron absorve energia, ele salta para um nível mais energético, se distanciando do núcleo (salto quântico), podendo até sair do átomo.
2) Quando perde energia, passa para um nível menos energético, se aproximando do núcleo.
3) Quando o elétron permanece com energia constante, ele gira ao longo de um mesmo nível.
O modelo atual é baseado no de Bohr, porém, trabalha as
regiões dos átomos, os dividindo em níveis. Esses níveis são,
respectivamente, s, sp, spd, spdf, spdf, spd e s.