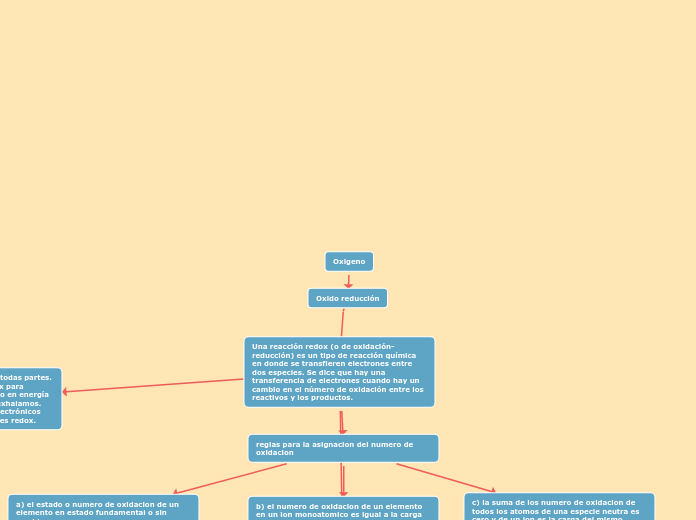
Oxigeno
Oxido reducción
Una reacción redox (o de oxidación-reducción) es un tipo de reacción química en donde se transfieren electrones entre dos especies. Se dice que hay una transferencia de electrones cuando hay un cambio en el número de oxidación entre los reactivos y los productos.
Tipos comunes de reacciones redox
Reacciones de combustión
Una reacción de combustión es una reacción redox entre un compuesto y una molécula de oxígeno (O2)
para formar productos que contienen oxígeno. Cuando uno de los reactivos es un hidrocarburo, los productos incluyen dióxido de carbono y agua.
Reacciones de desproporción
Una reacción de desproporción (o reacción de dismutación) es una reacción en la que un solo reactivo se oxida y se reduce al mismo tiempo
reglas para la asignacion del numero de oxidacion
a) el estado o numero de oxidacion de un elemento en estado fundamental o sin combinar es cero.
b) el numero de oxidacion de un elemento en un ion monoatomico es igual a la carga del ion.
c) la suma de los numero de oxidacion de todos los atomos de una especie neutra es cero y de un ion es la carga del mismo.