par Celine Blanco Miranda Il y a 3 années
318
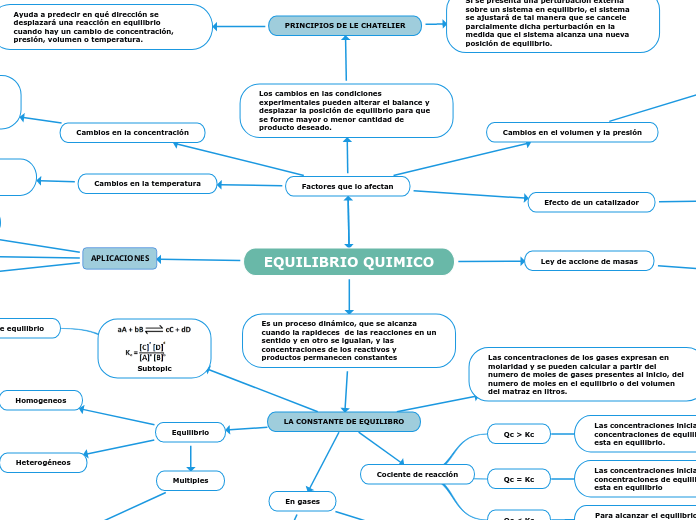
EQUILIBRIO QUIMICO
El equilibrio químico es un estado en el que las concentraciones de reactivos y productos permanecen constantes a lo largo del tiempo. Este equilibrio se puede analizar mediante el cociente de reacción Qc y la constante de equilibrio Kc.