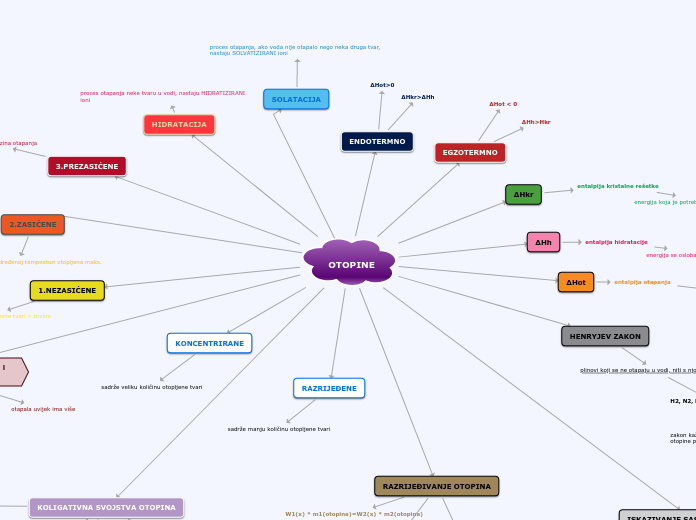
OTOPINE
KOLIGATIVNA SVOJSTVA OTOPINA
4.OSMOZA I OSMOTSKI TLAK
IZOTONIČNE OTOPINE - koje imaju jednake osmotske tlakove
HIPERTONIČNE OTOPINE - koje imaju vveći osmotski tlak od osmotskog tlaka promatrane otopine
HIPOTONIČNE OTOPINE - s manjim osmotskim tlakom od promatrane otopine
π= c * R * T * i
termodinamička temp. [K]
opća konst. 8.314JK-1 mol-1
množinska koncentracija [mol/dm3]
osmotski tlak [kPa]
3.SNIŽENJE LEDIŠTA
OTOPINE IMAJU NIŽE LEDIŠTE OD ČISTOG OTAPALA
tl(otopine)=tl(otapalo)-Δt
ΔT=Kf * b * i
KRIOSKOPSKA KONSTANTA OTAPALA [Kkg/mol]
razlika temp. [K]
2. POVIŠENJE VRELIŠTA
OTOPINE UVIJEK IMAJU VIŠE VRELIŠTE OD ČISTOG OTAPALA
tv(otopine)=tv(otapalo)+Δt
ΔT=Kb * b * i
broj čestica otopljene tvari
molalnost [mol/kg]
EBULIOSKOPSKA KOSTANTA OTAPALA [Kkg/mol]
razlika u temp. [K]
1.MANJI TLAK PARE OTAPALA IZNAD OTOPINA
i=broj čestica otopljene tvari
po porastu tlaka pare: Ca3(P4)2(s), MgCl2, NaCl, šećeri
što je veći broj čestica otopljene tvari tlak pare otapala je manji
RAULOV ZAKON
p=po + xo
množinski udio otapala xo=n(otapalo)/n(otopljene tvari) + n(otapalo)
X0<1
tlak pare otapala
tlak pare otopine [Pa]
NaCl (s) --H2O(l)--> Na+(aq) + Cl- i=2
MgCl2(s)--H20(l)--> Mg2+(aq) + 2Cl- i=3
Ca3(P4)2 (s)--H2O(l)--> 3Ca 2+(aq) + 2PO4 3-(aq) i=5
šećeri C6H12O6 (glukoza, fruktoza), C12H22O11 (saharoza) i=1
RAZRIJEĐIVANJE OTOPINA
c1(x) * v1(otopina)=c2(x) + v2(otopina)
γ1(x) * v1(otopina)=γ2(x) * v2(otopina)
W1(x) * m1(otopina)=W2(x) * m2(otopina)
ISKAZIVANJE SASTAVA OTOPINE
MOLALNOST
b(x)=n(x)/m(otapalo)
[mol/kg]
MNOŽINSKA KONCENTRACIJA
c(x)=n(x)/v(otopine)
[mol/dm3]
MASENA KONCENTRACIJA
γ(x)=m(x)/v(otopine)
ρ(otopine)=m(otopine)/v(otopine)
[g/dm3]
MASENI UDIO
W(x)=m(x)/m(otopine)
m(otopine)=(x)+m(otapala)
W(otapala)=m(otapala)/m(otopine)
[nema ili %]
HENRYJEV ZAKON
plinovi koji se ne otapaju u vodi, niti s njom reagiraju
H2, N2, He i djelomično O2
zakon kaže da je topljivost plinova proporcionalna taku iznad otopine pri određenoj temperaturi
veći tlak - veća topljivost
ENDOTERMNO
ΔHkr>ΔHh
ΔHot>0
EGZOTERMNO
ΔHh>Hkr
ΔHot < 0
ΔHot
entalpija otapanja
ovisi o hidrataciji i kristalnoj rešetci
ΔHh
entalpija hidratacije
energija se oslobađa kada nastaju hidratizirani ioni
ΔHkr
entalpija kristalne rešetke
energija koja je potrebna da se pokidaju veze u kristalu
ΔHkr > 0
SOLATACIJA
proces otapanja, ako voda nije otapalo nego neka druga tvar, nastaju SOLVATIZIRANI ioni
HIDRATACIJA
proces otapanja neke tvaru u vodi, nastaju HIDRATIZIRANI ioni
3.PREZASIĆENE
brzina kristlizacije > brzina otapanja
2.ZASIĆENE
kod njih je uspostavljena dinamička ravnoteža, odnosno brzina kristalizacije = brzini otapanja
otopine kod kojih je pri određenoj tempeaturi otopljena maks. količina otopljenih tvari
1.NEZASIĆENE
otopine koje sadrže malu količinu otopljene tvari > brzina kristalizacije
RAZRIJEĐENE
sadrže manju količinu otopljene tvari
KONCENTRIRANE
sadrže veliku količinu otopljene tvari
homogene smjese sastavljene od otapala i otopljene tvari
otapala uvijek ima više
otopljena tvar - tvar koja se otapa
otapalo - tvar u kojoj se neka tvar otapa