par Elizabeth López Solano Il y a 5 années
674
Organigrama
par Elizabeth López Solano Il y a 5 années
674

Plus de détails
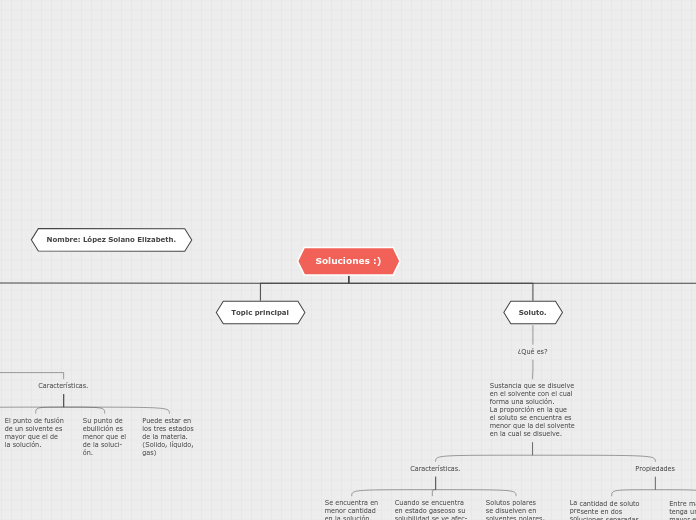
Toda solución química tiene como mínimo dos componentes los cuales son el soluto y disolvente.
La formación de soluciones y mezclas es fundamental para el desarrollo de nuevos materiales y para el entendimiento de las fuerzas químicas que permiten a la mate ria combinarse
Sus componentes solo se pueden separa por cristalización, destilación o cromatografía.
Destilación.
Cristalización.
Cromatografía.
No se pueden distinguir sus elementos a simple vista.
Sus componentes no se pueden separa por métodos físicos (Filtración, tami- zado,etc).
Propiedades
Entre más partículas tenga un soluto, mayor es el punto de ebullición de la solución y menor es el punto de fusión.
La cantidad de soluto presente en dos soluciones separadas por una membrana semipermeable tiene un efecto en el fenómeno de la ósmosis.
Solutos polares se disuelven en solventes polares, solutos no polares se disuelven en solventes no pola- res.
Cuando se encuentra en estado gaseoso su solubilidad se ve afec- tada por la presión, el volumen y la tempera- tura.
Se encuentra en menor cantidad en la solución
Puede estar en los tres estados de la materia. (Solido, líquido, gas)
Su punto de ebullición es menor que el de la soluci- ón.
El punto de fusión de un solvente es mayor que el de la solución.
Se encuentra en mayor proporción en la solución.
Tipos de disolventes.
Apolares.
Sustancias químicas o mezclas de las mismas que son capaces de disolver sustancias hidrosolubles, debido a propiedades disolventes tiene múltiples aplica- caciones en la tecnolo- gías industriales y en los laboratorios de investigación.
Ejemplos:
Benceno.
Cloroformo.
Éter dietílico.
Polares.
Disuelven sustancias polares por interacci- nes electrostáticas en- tre dipolos. Ejemplo: Agua.