par ISRAEL TORRES PIOQUINTO Il y a 7 années
662
Química
par ISRAEL TORRES PIOQUINTO Il y a 7 années
662

Plus de détails
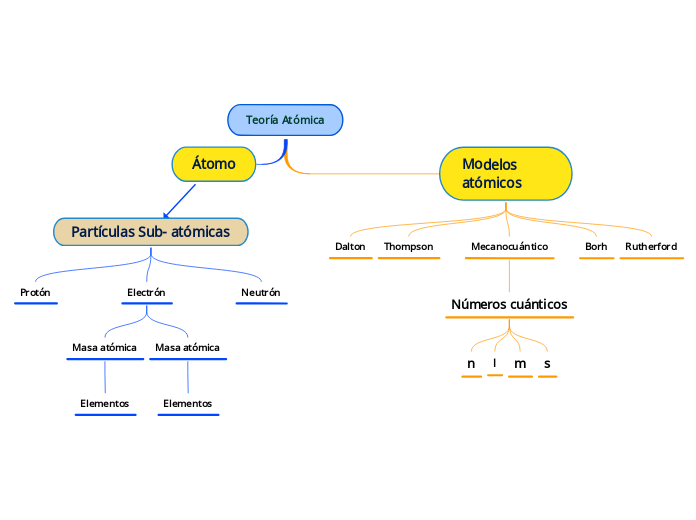

par Patricia Guadalupe Linares de Hernandez

par ANGIE KATERINE KAMMERER MEZA (:-)
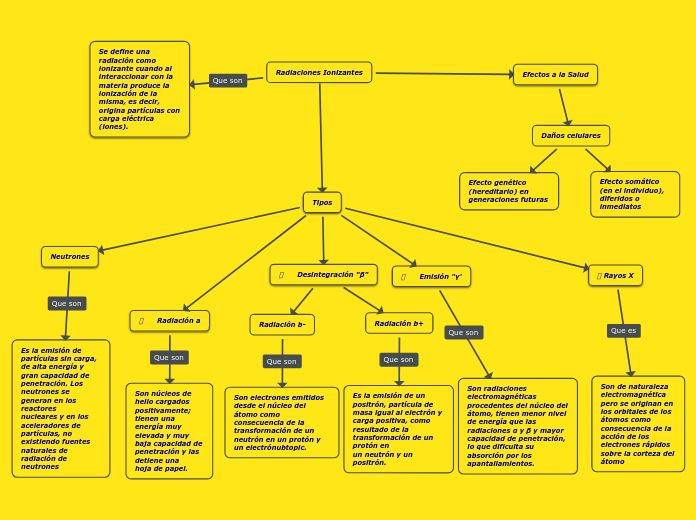

par Eclainy Moaa Montero

par Amanda Perez