par Jazmin Arriola Il y a 2 années
224
TIPOS DE REACCIONES
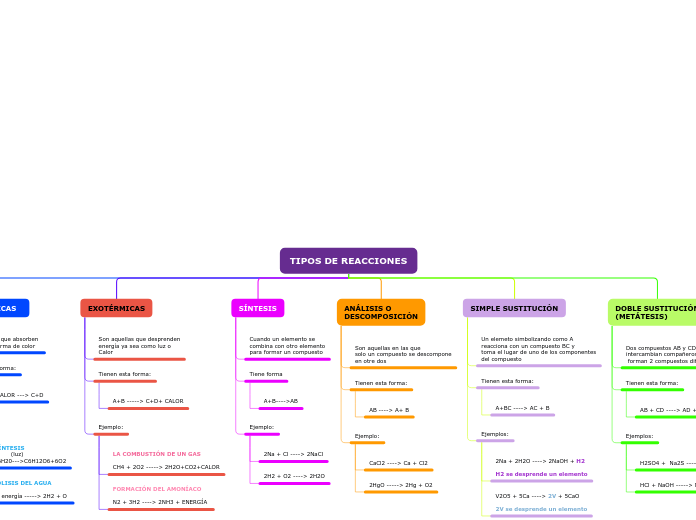
Las reacciones químicas se pueden clasificar en varios tipos básicos según el intercambio de energía y los cambios en los compuestos involucrados. Las reacciones endotérmicas absorben energía, como ocurre en la fotosíntesis, donde el dióxido de carbono y el agua se transforman en glucosa y oxígeno utilizando luz.