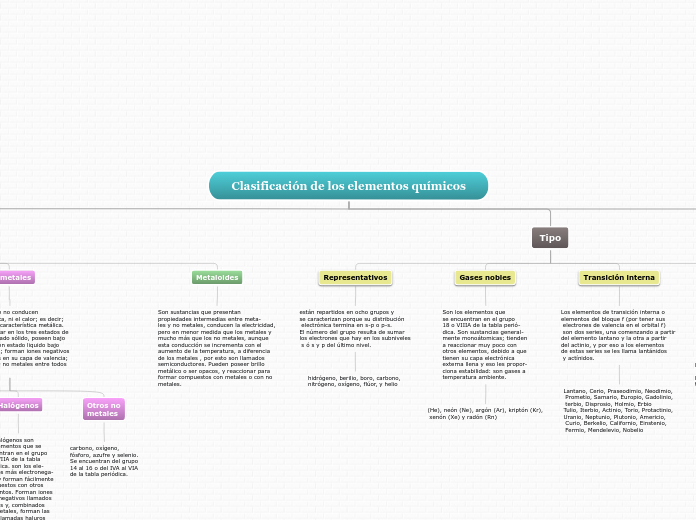
Clasificación de los elementos químicos
Clase
Metales
Son sustancias cuyos atómos conducen
muy bien el calor y la electricidad a un sopla-
miento de las bandas de valencia y conducción
donde se encuentran los electrones; los atómos
forman entre sí un enlace metálico. General-
mente son sólidos a temperatura ambiente, con
un elevado punto de fusión, reflejan la luz, brillo
forman iones positivos al perder sus electrones
de valencia, tienen propiedades de ser maleables
y ductiles.
Alcalinos
Son los elementos
que se encuentran en
el grupo 1 o IA de la
tabla periodica;meta-
les que forman álcalis
o soluciones acuosas con
un carácter básico.
Alcalinotérreos
Son los elementos
que se encuentran en
el grupo 2 o IIA de la
tabla periodica. Este
nombre proviene de sus
óxidos, antes se les
llamaba tierras. Las solu-
ciones en agua de estos
óxidos tienen propiedades
alcalinas o básicas.
Metales de transición
Son los elementos que se
encuentran en los grupos
del 3 al 12 o del IB al VIIIB
en la tabla periódica, osea,
en el centro. Estos metales
tienen, en el penúltimo nivel
de energía, un subnivel d en
donde se encuentran los elec-
trones de valencia, que
determinan sus propiedades.
Metales del bloque p
Se encuentran en los grupos
del 12 al 16 o del IIIA al VIA
de la tabla periódica, están
junto a los metaloides y suelen
ser algo blandos con puntos de
fusión no muy altos, aunque
poseen características metálicas.
En el último nivel energético se
encuentra el subnivel p con los
electrones de valencia.
Metales de bloque f
Metales lantánidos y actínidos:
están en las dos filas interiores de
la tabla periódica y ocupan la misma
posición que el lantano y el actinio.
No metales
Son sustancias que no conducen
la corriente eléctrica, ni el calor; es decir;
no tienen ninguna característica metálica.
Se pueden encontrar en los tres estados de
agregación; en estado sólido, poseen bajo
punto de fusión y en estado liquido bajo
punto de ebullición; forman iones negativos
al ganar electrones en su capa de valencia;
solo se conocen 19 no metales entre todos
los elementos.
Gases nobles
Son los elementos que
se encuentran en el grupo
18 o VIIIA de la tabla perió-
dica. Son sustancias general-
mente monoátomicas; tienden
a reaccionar muy poco con
otros elementos, debido a que
tienen su capa electrónica
externa llena y eso les propor-
ciona estabilidad: son gases a
temperatura ambiente.
Halógenos
Los halógenos son
los elementos que se
encuentran en el grupo
17 o VIIA de la tabla
periódica. son los ele-
mentos más electronega-
tivos y forman fácilmente
compuestos con otros
elementos. Forman iones
mononegativos llamados
haluros y, combinados
con metales, forman las
sales llamadas haluros
metálicos.
Otros no
metales
carbono, oxígeno,
fósforo, azufre y selenio.
Se encuentran del grupo
14 al 16 o del IVA al VIA
de la tabla periódica.
Metaloides
Son sustancias que presentan
propiedades intermedias entre meta-
les y no metales, conducen la electricidad,
pero en menor medida que los metales y
mucho más que los no metales, aunque
esta conducción se incrementa con el
aumento de la temperatura, a diferencia
de los metales , por esto son llamados
semiconductores. Pueden poseer brillo
metálico o ser opacos, y reaccionar para
formar compuestos con metales o con no
metales.
Tipo
Representativos
están repartidos en ocho grupos y
se caracterizan porque su distribución
electrónica termina en s-p o p-s.
El número del grupo resulta de sumar
los electrones que hay en los subniveles
s ó s y p del último nivel.
hidrógeno, berilio, boro, carbono,
nitrógeno, oxígeno, flúor, y helio
Gases nobles
Son los elementos que
se encuentran en el grupo
18 o VIIIA de la tabla perió-
dica. Son sustancias general-
mente monoátomicas; tienden
a reaccionar muy poco con
otros elementos, debido a que
tienen su capa electrónica
externa llena y eso les propor-
ciona estabilidad: son gases a
temperatura ambiente.
(He), neón (Ne), argón (Ar), kriptón (Kr),
xenón (Xe) y radón (Rn)
Transición interna
Los elementos de transición interna o
elementos del bloque f (por tener sus
electrones de valencia en el orbital f)
son dos series, una comenzando a partir
del elemento lantano y la otra a partir
del actinio, y por eso a los elementos
de estas series se les llama lantánidos
y actínidos.
Lantano, Cerio, Praseodimio, Neodimio,
Prometio, Samario, Europio, Gadolinio,
terbio, Disprosio, Holmio, Erbio
Tulio, Iterbio, Actinio, Torio, Protactinio,
Uranio, Neptunio, Plutonio, Americio,
Curio, Berkelio, Californio, Einstenio,
Fermio, Mendelevio, Nobelio
Transición
Los elementos de transición son
aquellos que tienen la subcapa d
o f parcialmente llena en cualquier
estado de oxidación común.
En total son 44 elementos que
conforman los metales de transición,
los cuales ocupan gran parte de la
tabla periódica en su zona central:
Escandio. Titanio. Vanadio.
Configuración electrónica
nos dice como están ordenados los electrones en los distintos niveles de energía (órbitas), o lo que es lo mismo como están distribuidos los electrones alrededor del núcleo de su átomo.
Bloque S
Grupo 1 y 2
Los del bloque s forman los grupos IA y IIA,
cuyos electrones de valencia se encuentran
en los subniveles ns1 y ns2, respectivamente.
Metales
Alcalinoterreos
Bloque d
Las configuraciones electrónicas de
su capa de valencia tienen la forma
ns2(n-1)d1, ns2(n-1)d2, ns2(n-1)d3,
ns2(n-1)d4, ns2(n-1)d5, ns2(n-1)d6,
ns2(n-1)d7, ns2(n-1)d8, ns2(n-1)d9,
ns2(n-1)d10.
Bloque p
Grupo 3-8
sus configuraciones electrónicas de la
capa de valencia tienen la forma ns2np1,
ns2np2, ns2np3, ns2np4, ns2np5 (halógenos
Bloque f
lantánidos y
atinidos
poseen configuraciones electrónicas
de la capa de valencia de la forma
ns2(n-2)f1-14.