Equilibrio Químico
Se alcanza cuando
Las reacciones netas de reactivos y productos permanecen constantes
Las velocidades de las reacciónes directa e inversa se igualan
Condiciones
Sistema cerrado

Reacción reversible

Constante de equilibrio
Factores que alteran el equilibrio
Principio de Le Chatelier
Temperatura
Si se incrementa la temperatura, se favorece el sentido endotérmico de la reacción.
Una disminución de la temperatura, favorece el sentido exotérmico de la reacción.
Concentración
Si se incrementa un producto, el sistema lo consumirá parcialmente, favoreciendo el sentido inverso de la reacción.
Si se incrementa un reactivo, el sistema lo consumirá parcialmente, favoreciendo el sentido directo de la reacción.
Volumen y Presión
Si aumenta la presión de un sistema gaseoso en equilibrio, el sistema se desplaza hacia donde hay menor número de moles gaseosos.
Si disminuye la presión de un sistema gaseoso en equilibrio, el sistema se desplaza hacia donde hay mayor número de moles gaseosos.
Si disminuye el volumen de un sistema gaseoso en equilibrio, el sistema se desplaza hacia donde hay menor número de moles gaseosos.
Si aumenta el volumen de un sistema gaseoso en equilibrio, el sistema se desplaza hacia donde hay mayor número de moles gaseosos.
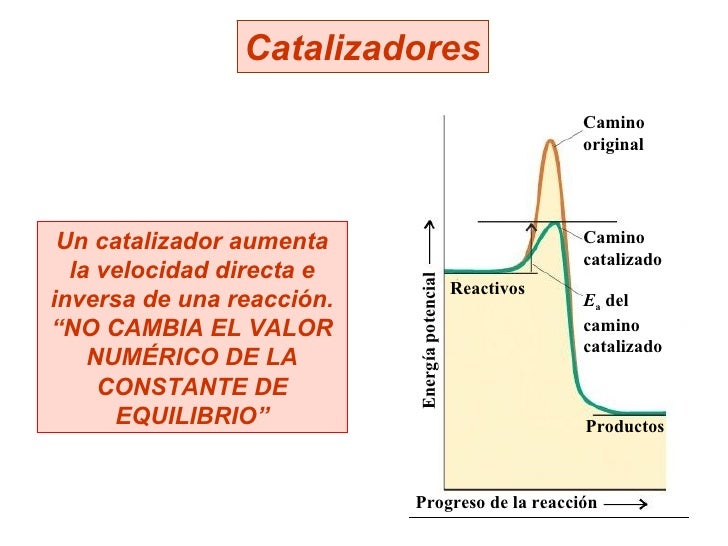
Efecto de un catalizador
La presencia del mismo no modifica la
constante de equilibrio, y tampoco desplaza la posición de un sistema en equilibrio
Disminuye la energía de activación
de la reacción directa e inversa en la misma magnitud
Si le añade a una reacción que no está en equilibrio solo provocará que la mezcla alcance más rápido el equilibrio
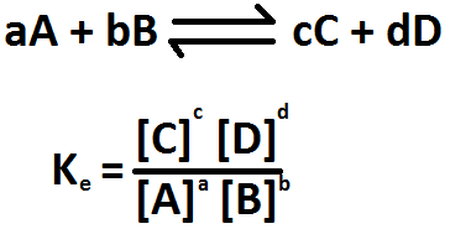
Ley de Acción de Masas
Su magnitud indica si la reacción es favorable a los productos o a los reactivos
Si K >> 1 se favorece la formación de productos
y el equilibrio se desplazará hacia la derecha
Si K << 1 se favorece la formación de reactivos y el equilibrio se desplazará hacia la izquierda
Equilibrios
Homogéneos

Heterogéneros

Múltiples

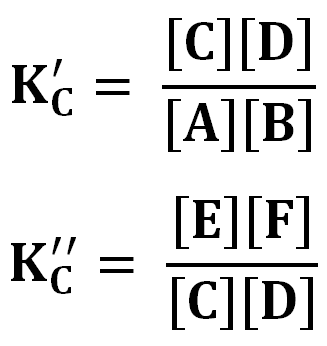
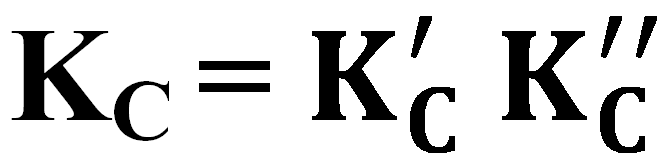
Kp
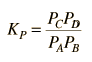
Kc
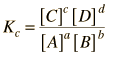
K'

Cociente de reacción
Qc<Kc
Qc=Kc
Qc>Kc
Subtema
Relación Kp-Kc
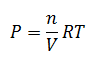
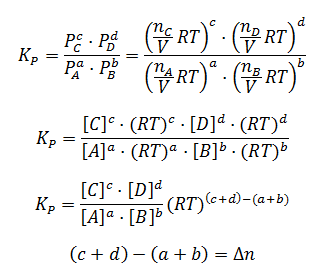
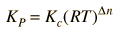
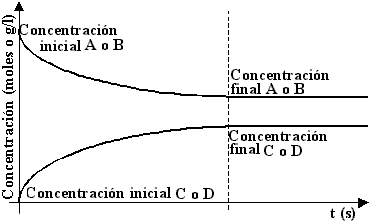
Relación Cinética Química y Equilibrio Químico



Calcular Concentraciones de Equilibrio
1. Expresamos las concentraciones de equilibrio de las especies como la concentración inicial y una variable
desconocida x, que representa el cambio en la concentración.
2. Escribimos la expresión de la constante de equilibrio en términos de estas concentraciones. Conociendo el valor de K, despejamos para x
3. Luego de resolver por x, calculamos las concentraciones de equilibrio para todas las especies.