Enfermedad valvular degenerativa
Signología clínica

Soplo holosistólico (de regurgitación mitral)

Edema pulmonar (fulminante)
Ascitis
Tos
Síncope

Dificultad respiratoria
Intolerancia al ejercicio
Colapso
Distención venosa yugular
Taquiarritmia
Shock cardiogénico
Muerte súbita
Fisiopatología
Primeras fases
Elongamiento de cuerdas tendinosas y laxitud de tejido valvar produce prolapso mitral, sin regurgitación
Evolución
Falla de coaptación de valvas, comienza regurgitación de sangre de ventrículo hacia aurícula, produciendo soplo. Prolapso mitral con posterior retracción valvular y presencia de regurgitación mitral, provocando alteraciones cardiovasculares que activan mecanismos compensatorios que terminan desencadenando la IC

Histopatología
Expansión de pars spongiosa (toma apariencia de tejido mixomatoso), invade y provoca disrupción focal de pars fibrosa (hialinización, dilatación y fragmentación de haces, restos aislados de capa fiibrosa).

Macroscópico
Engrosamiento de valvas de válvulas mitral y tricúspide, lesiones puntiformes a nodulares que se unen, aumentando tejido valvular y retracción. Con el tiempo hay hipertrofia de AI y VI, en cavidades cardiacas derechas variable.

Plan diagnóstico
Auscultación
Detectando el soplo, su grado y localización. El grado puede correlacionarse con la gravedad de la patología.
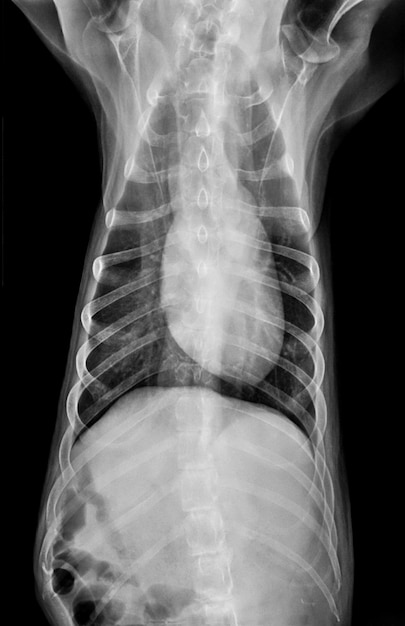
Radiografía de tórax
Para valorar las modificaciones cardiacas (aumento AI, VI, cardiomegalia gradual) y la presencia de signos de congestión cardiopulmonar.
ECG
Para evaluar la presentación de arritmias y sugerir la existencia de una cardiomegalia. Valvas de válvula mitral hipertróficas y prolapsadas con dilatación de VI y AI, regurgitación mitral en Doppler confirman dx.
Ecocardiografía
Para visualizar mejor la lesión y las modificaciones que ocasiona, y determinar la funcionalidad cardiaca.
Bioquímica sanguínea
Para controlar la función renal y hepática, si se ven afectadas por mecanismos de compensación que llevan a ICC
Biomarcadores
Troponina cTnI elevada en sangre indica lesión de miocardio
Péptido natriurético cerebral o de tipo B (BNP) o del extremo nitrogenado de su prohormona (NT-pBNP) sugiere cardiopatía estructural y sobrecarga de volumen, con ICC manifiesta o sin esta. Para predecir estadio B2.
Plan terapéutico
Estadios A y B1
No existe
Estadio B2
Pimobendan 0.2-0.3 mg/kg PO c/12 hrs

Inhibidor de la ECA o espirinolactona

Estadios C y D
Furosemida

Pimobendán
Enalapril/Benazepril/Quinapril
Espirinolactona
Vasodilatadores
Nitroprusiato de sodio
Nitroglicerina
Amlodipino
Hidralazina
Inhibidor de la PDE-V
Sildenafil
Antiarritmicos
Sedación
Oxígenoterapia

Abdominocentesis
Dieta baja en sodio, con suficientes calorías y proteína de calidad
Etiología

Desconocida
Teorías
Factores genéticos
Discolagenósis
Sinonimias
Enfermedad valvular crónica (EVC)
Degeneración valvular crónica
Enfermedad valvular mixomatosa
Endocardiosis valvular crónica
Regurgitación mitral
¿Qué es?
Patología cardiovascular de mayor prevalencia en caninos, principal causa de insuficiencia cardiaca. Lleva a sobrecarga de volumen con hipertrofia excéntrica e ICC
Enfermedad crónica degenerativa (degeneración mixomatosa), no infecciosa, de las válvulas aurículo-ventriculares, llegando a afectar las cuerdas tendinosas. Su deformación provoca una regurgitación (mitral y luego tricúspide). Esta lesión es progresiva (lenta) e irreversible

Afecta principalmente a perros de razas pequeñas y edad avanzada (>7 años), raro en gatos
Pronóstico
Es variable y no puede concretarse en las primeras fases de la enfermedad. Para determinarlo evaluar progresión del proceso, valorando modificaciones.
Paciente asintomático con soplo
Progresión lenta, podría no desarrollar signos de IC
Algunos casos o razas con evolución rápida y desfavorable en 1-2 años
Rotura de cuerdas tendinosas, con pronostico desfavorable a corto plazo, poco frecuente
Paciente con soplo y signos de IC
Empeoramiento progresivo
Empeoramiento brusco
Rotura de cuerda tendinosa
Aparición de fibrilación auricular
Fase avanzada no diagnosticada
Clasificación de pacientes
Estadío A
Perros en riesgo de valvulopatía
mixomatosa.
Estadio B
Perros con signos objetivos de MMVD
(soplo de RM), pero sin signos de IC
B1
Tamaño del corazón es normal, o
la cardiomegalia es insuficiente para
comenzar el tratamiento
B2
Remodelación
(cardiomegalia) suficiente para
comenzar el tratamiento
Estadio C
Perros que actualmente tienen o han
tenido ICC (y están en tratamiento)
Estadío D
Perros con ICC resistentes a la
farmacoterapia y dosis habituales, requiere hospitalización y terapia avanzada
Suele confundirse con
Cardiomiopatía dilatada
¿Qué es?
Patología caracterizada por una baja contractibilidad miocárdica, con o sin arritmias. Generalmente comienza en el VI, su dilatación y disfunción sistólica da lugar a las manifestaciones clínicas de IC, arritmias, y enfermedad tromboembólica. El corazón no puede bombear sangre, ya que el ventrículo se estira y se dilata, y finalmente, los órganos del cuerpo comienzan a sufrir daños por inadecuado suministro de sangre y oxígeno.

Más frecuente entre los 4-10 años, en razas medianas a gigantes
Etiología
Primaria/idiopática

Secundaria
Procesos inflamatorios (miocarditis)
Procesos endocrinos (hipotiroidismo)
Nutricional (deficit de Taurina o L carnitina)
Por agentes infecciosos (parvovirosis)
Por agentes tóxicos (doxorrubicina)
Inducida por taquicardias supraventriculares
Taquicardia
Predisposición genética familiar

Fisiopatología
La progresiva degeneración y atrofia del los cardiomiocitos conduce a una disfunción en su capacidad de contracción, por lo que el gasto cardiaco por minuto disminuye. La actividad compensatoria simpática, hormonal y renal estabiliza mediante el incremento del volumen sanguíneo circulante, de la frecuencia cardiaca y de la presión sanguínea. El incremento de la presión al final de la diástole conduce a una dilatación de las cámaras cardiacas. Los mecanismos compensatorios llevan a una congestión venosa y en último término fallo cardiaco congestivo.
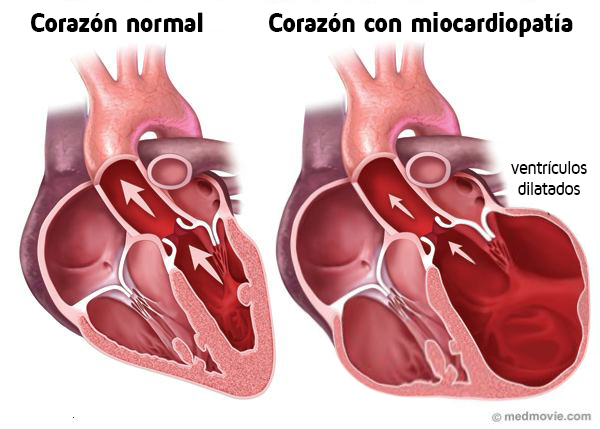
Las consecuencias hemodinámicas son que se distienden los anillos de las válvulas auriculoventriculares permitiendo el reflujo de sangre hacia las aurículas lo que aumenta la presión auricular, las aurículas se dilatan, la presión de las venas aumenta por detrás del corazón lo que termina produciendo una ICC.
En etapas finales de la enfermedad el gasto cardiaco termina por disminuir pudiendo producir un shock de origen cardiogénico, hipoxia miocárdica, arritmias y muerte súbita.
Tres fases
Fase I
Corazón eléctrica y morfológicamente normal
Fase 2 (oculta)
Cambios morfológicos y/o eléctricos sin sintomatología clínica
Fase 3 (clínica)
Signos clínicos de ICC, arritmias o ambos
Signología clínica
Arritmia
Soplo cardiaco

Respiración dificultosa
Agitación excesiva
Edema pulmonar
Cianosis

Tos
Sincope
Ascitis

Edema subcutáneo
Congestión hepática o esplénica
Intolerancia al ejercicio
Desmayos
Azotemia prerenal
Hipertensión sistémica
Falta de apetito

Debilidad y letargo
Muerte súbita
Plan diagnóstico
ECG
Detección de arritmias supraventriculares, valoración de función sistólica y diastólica, anatomía y tamaño de las cámaras

Estudios Holter
Detección de problemas arritmogénicos

Biomarcadores cardiacos
Troponina cardiaca cTnl
NT-Pro BNP
Radiografía de tórax
DX de fallo cardiaco congestivo, por patrón alveolar de edema pulmonar y congestión venosa. Permite evaluar tamaño y forma del corazón
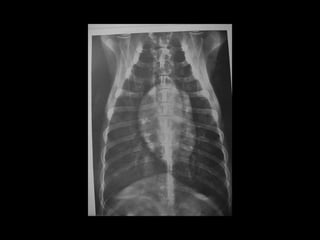
Índice Cardiaco Vertebral de Buchanan

Medición de FR en reposo
Para monitorización
Plan terapéutico
Furosemida
Inhibidores de la ECA
Enapril
Betabloqueantes
Carvedilol
Pimobendan
Espirinolactona
Pomadas de nitroglicerina
Infusiones de nitroprusiato de sodio y/o dobutamina
Pronóstico
Fase subclínica
Puede durar años. El diagnóstico precoz y el manejo de la enfermedad en esta etapa puede mejorar mucho y alargar el tiempo en esta fase.

Fase clínica
Grave, esperanza de vida no mayor a 2 años. Enfoque en mantener calidad de vida.