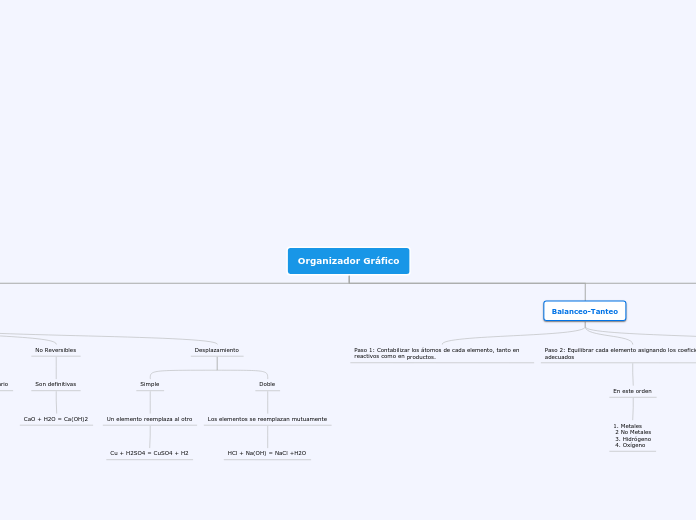
Organizador Gráfico
Tipos de Reacciones
Adición
Suma y unión de los reactivos
2 H2 + O2 = 2 H2O
Descomposición
Separación de los reactivos
2 H2O = 2 H2 + O2
Endotérmicas
Absorben calor
CaCO3 + calor = CaO + CO2
Exotérmicas
Producen calor
CaO + H2O = Ca(OH)2 + calor
Reversibles
Reaccionan en sentido contrario
2 H2 + O2=2 H2O
No Reversibles
Son definitivas
CaO + H2O = Ca(OH)2
Desplazamiento
Simple
Un elemento reemplaza al otro
Cu + H2SO4 = CuSO4 + H2
Doble
Los elementos se reemplazan mutuamente
HCl + Na(OH) = NaCl +H2O
Balanceo-Tanteo
Paso 1: Contabilizar los átomos de cada elemento, tanto en reactivos como en productos.
Paso 2: Equilibrar cada elemento asignando los coeficientes adecuados
En este orden
1. Metales
2 No Metales
3. Hidrógeno
4. Oxígeno
Paso 3: Verificar la Igualdad
Aplicaciones en la Vida Cotidiana
2
En la elaboración de plástico, que proceden del petroleo, el cual esta formado de sustancias llamadas hidrocarburos
En la oxidación de los metales, un proceso muy común entre los que ns rodean, el principal elemento aquí es el oxígeno.