QUIMICA
IF
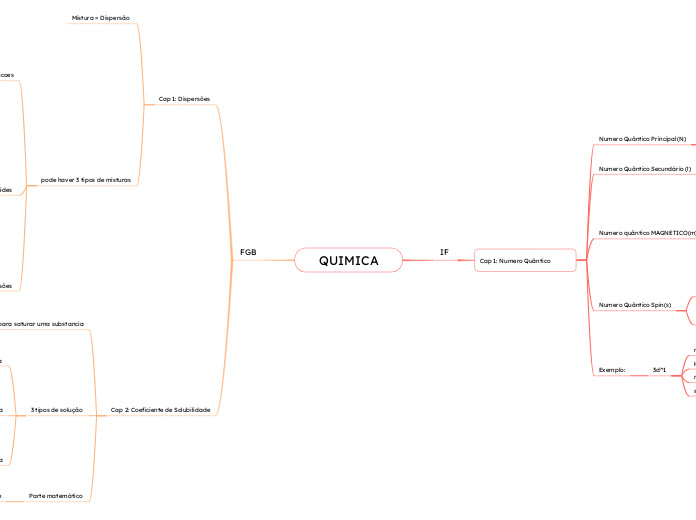
Numero Quântico Principal(N)
K L M N O P Q
1 2 3 4 5 6 7
Numero Quântico Secundário (l)
S P d F
0 1 2 3
Numero quântico MAGNETICO(m)
Representação
Orientação Espacial das Orbitas
Associado
ao numero quântico secundário
S
0
Numero de Orbitais (ou de Caixas)
1
p
-1 0 1
3
d
-2 -1 0 1 2
5
f
-3 -2 -1 0 1 2 3
7
Numero Quântico Spin(s)
Setas = Elétrons
Votação e Translação
-1/2
Setas para cima
+1/2
setas para baixo
Obs: sempre tem começar a colocar setas para cima
e só depois terminar com setas para baixo
Exemplo:
3d^1
n=3
l=2
m= -2
s= -1/2
FGB
Cap 1: Dispersões
Mistura = Dispersão
pode haver 3 tipos de misturas
Solucoes
Misturas Homogêneas
Não ocorre sedimentação
Partícula < 1 nm
1 nm = 1 * 10^9 m
Exemplo:
Agua + Sal ou Açúcar
Leite + Toddy
outros tipos de estados
Gasosos
Ar atmosférico
Sólidos
ligas metálicos
Aço
Bronze
Coloides
Mistura Heterogênea
Partícula entre 1 a 1000 nm
não sedimentação
parecidos a misturas homogêneas a olho nu
Exemplo
Detergente de agua
maionese
queijo
Fumaça
Suspensões
Mistura Heterogênea
Partícula > 1000 nm
Sedimentação através de decantação
Exemplo:
Granito
Agua + Areia
Cap 2: Coeficiente de Solubilidade
quantidade necessária para saturar uma substancia
determinado pela T e P
Subtópico
3 tipos de solução
Saturada
CS= SOLUTO
Equilíbrio
ponto de saturação atingido
máxima quantidade dissolvida
Insaturada
SOLUTO < CS
Não equilíbrio
menos solubilidade que o estabelecido
Supersaturada
SOLUTO > CS
Não equilíbrio
podem precipitar
mais Nescau que o normal
Parte matemático
Literalmente
Regra de 3 BASICA