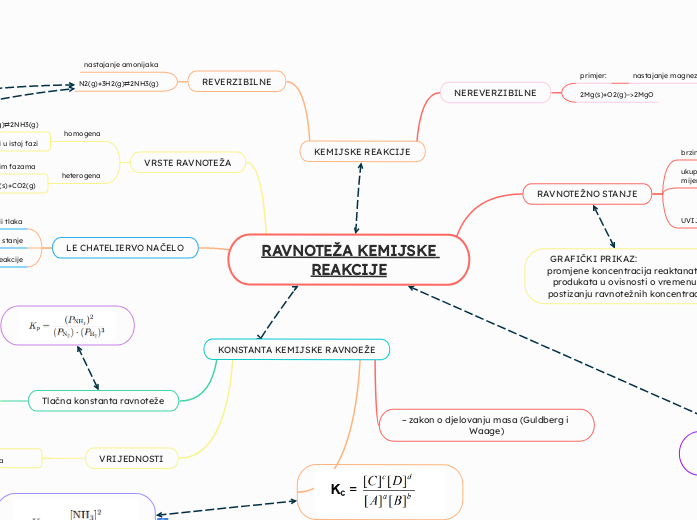
RAVNOTEŽA KEMIJSKE REAKCIJE
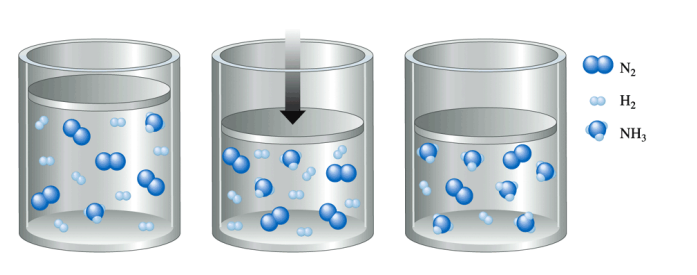
RAVNOTEŽNO STANJE
brzina napredne i povratne reakcije jednake
ukupna koncentracija sudionika reakcije se ne mijenja
UVIJETI:
reakcija mora biti reverzibilna (povrativa)
sustav mora biti zatvoren
temperatura i tlak moraju biti stalni
VRSTE RAVNOTEŽA
homogena
N2(g)+3H2(g)⇄2NH3(g)
sve tvari u istoj fazi
heterogena
tvari u različitim fazama
CaCO3(s)⇄CaO(s)+CO2(g)
LE CHATELIERVO NAČELO
promjena konc. sudionika, temp. ili tlaka
sustav pokušava uspostaviti ravnotežno stanje
promjena brzine napredne i povratne reakcije
KEMIJSKE REAKCIJE
NEREVERZIBILNE
primjer:
nastajanje magnezijevog oksida
2Mg(s)+O2(g)−>2MgO
REVERZIBILNE
nastajanje amonijaka
N2(g)+3H2(g)⇄2NH3(g)
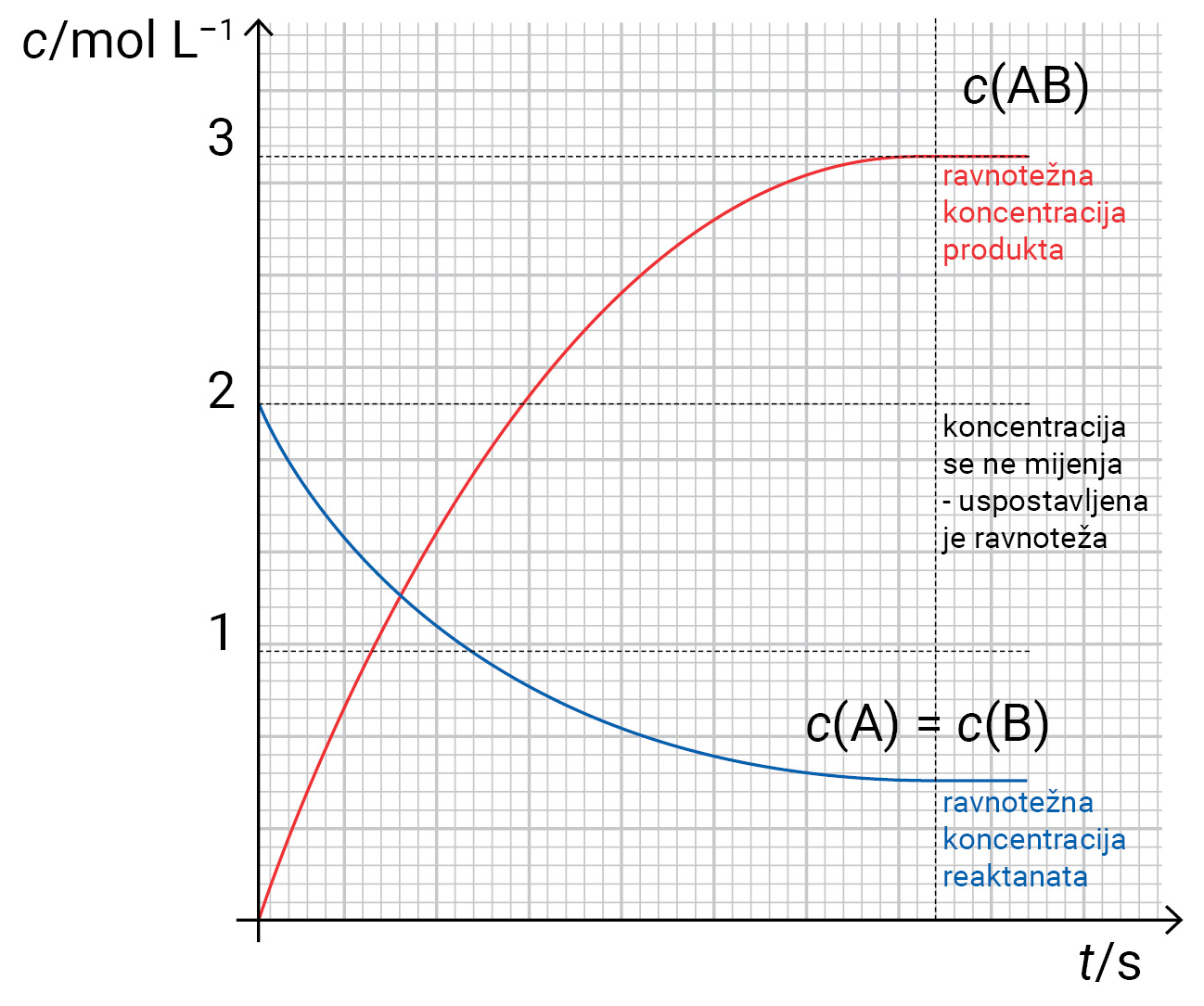
GRAFIČKI PRIKAZ: promjene koncentracija reaktanata i produkata u ovisnosti o vremenu i postizanju ravnotežnih koncentracija
KONSTANTA KEMIJSKE RAVNOEŽE
– zakon o djelovanju masa (Guldberg i Waage)

Tlačna konstanta ravnoteže
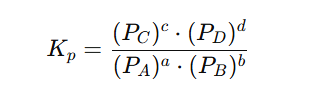
VRIJEDNOSTI
K < 1 ⇒ ravnoteža pomaknuta na stranu reaktanata
K > 1 ⇒ ravnoteža pomaknuta na stranu produkata
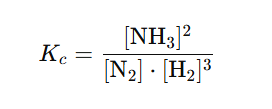
VRIJEDNOST ZA DAN PRIMJER
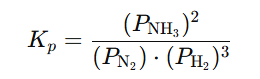
Utjecaj promjene temperature, tlaka i koncentracije na ravnotežno stanje kemijskog sustava
2NO(g) + O2(g) ⇄ 2NO2(g)
TLAK
Povečanje tlaka-
Udesno prema produktima
Smanjenje tlaka-
Ulijevo prema reaktantima
TEMPRERATURA
ΔrH ∘<0
Egzotermna reakcija
Povečanje temperature-
Ulijevo prema reaktantina
Smanjenje temperature-
Udesno prema produktima
KONCENTRACIJA
NO
Smanjenje
Ulijevo prema reaktantima
Povećanje
Udesno prema produktima
O2
Povećanje
Udesno prema produktima
Smanjenje
Ulijevo prema reaktantima
NO2
Povećanje
Ulijevo prema raktantima
Smanjenje
Udesno prema produktina
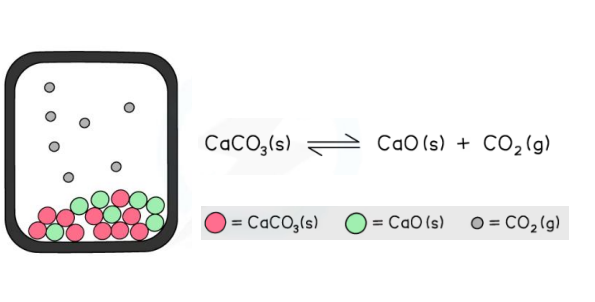
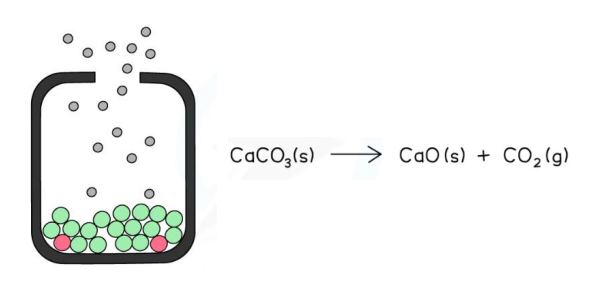
NIJE KEMIJSKA RAVNOTEŽA