SOLIDOA
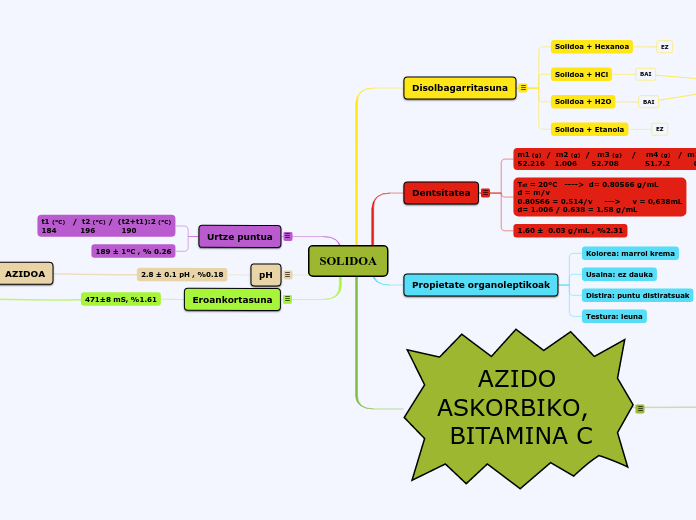
Disolbagarritasuna
HelburuaGure solidoa indetifikatzeko apolarra edo polarra eta organiko edo ezorganiko den determinatzea.Oinarri teorikoaSolidoa+ H2O = PolarraSolidoa + HCl = Ez organikoaSolidoa + Hexanoa = ApolarraSolidoa + Etanola = Disolbagaitza Materiala ErreaktiboakGradila Ur destilatua Saiodia HexanoaEspatula EtanolEnbutua HClPasteu pipeta Solido problemaHagatxoaHauspeakin ontziaProzeduraLau saiodi desberdinetan, solido problema pixka bat bota (disolbatzen den ikusteko nahikoa dena).Bete saiodia erdiraino honako likido bakoitzarekin:H20HexanolEtanolHClHagatxoarekin nahastu disolbatzen den ikusi arte.
Solidoa + Hexanoa
EZ
Solidoa + HCl
BAI
Solidoa + H2O
BAI
Solidoa + Etanola
EZ
Dentsitatea
HelburuaPiknometroaren bidez gure solido ezezagunaren dentsitatea kalkulatuOinarri teorikoa Dentsitatea kalkulatzeko, disolbagaitza den likido batekin nahastu da, gure kasuan etanolarekin. Dentsitatea= masa(g)/bolumena (mL)Materiala ErreaktiboakPiknometroa 25 mL EtanolaEnbutu pisagailua Solido problemaBalantzaEspatulaTermometroaProzeduraAurreko praktikaren bidez, gure solidoarentzat likido disolbagaitza aukeratu. Gure kasuan Etanola.Etanolaren T (ºC) neurtu termometroarekin.25mL-ko pikonometroa Etanolez arraseraino bete eta masatu (m1).Solido problema masatu (m2)Solidoa piknometroan sartu eta arraseraino bete Etanolarekin.Piknometroaren kanpoko paretak ondo lehortu et masatu (m3).Prozedura*3.Kalkuluak egin (m4, kanporatutako etanola eta solidoaren dentsitatea)Bataz bestekoa, desbiderazioa eta RSD kalkulatu.
m1 (g) / m2 (g) / m3 (g) / m4 (g) / m1-m4 (g) / d (g/mL)
52.216 1.006 52.708 51.7.2 0.514 1.58
Tet = 20ºC ----> d= 0.80566 g/mL
d = m/v
0.80566 = 0.514/v ---> v = 0,638mL
d= 1.006 / 0.638 = 1.58 g/mLundefined
1.60 ± 0.03 g/mL , %2.31
Propietate organoleptikoak
Kolorea: marroi krema
Usaina: ez dauka
Distira: puntu distiratsuak
Testura: leuna
AZIDO ASKORBIKO,
BITAMINA C
Erreferentziazko balioak vs gure balioak:Disolbagarritasuna: Teorian: H2O eta HClPraktikan: H2O eta HClDentsitatea: Teorian: 1,65g/mLPraktikan: 1,60±0,03 g/mLUrtze puntua: Teorian: 190-192ºCPraktikan:189±1 ºCpH : Teorian: 2,4Praktikan: 2.8±0.1Eroaletasuna : Teorian: 500 msPraktikan: 471±8 mS Hona hemen, Azido Askorbikoaren molekularen irudia, lortu ditugun emaitzek zentzu gehiagorekin ikusteko, molekularen konposizoa, ordena eta egitura ikusiz.
aUrtze puntua
HelburuaThiele metodoaren bidez, solidoaren urtze puntua determinatzea Materiala ErreaktiboakThiele tutua Silikona Tapoia Solido problema Termometroa3 KapilarErloju beiraAlambreaBunsen metxeroaMuntaia ProzeduraSolido problema birrindu, kapilarrean sartzeko, 1 cm inguru. Kapilarra alambrearen bidez, termometrora lotu, beheko zatian.Thiele tutua silikonaz bete.Muntaiaren bidez Thiele tutua eta termometroa eutsi eta termometroa silikonan murgildu.Bunsen metxeroa piztu eta Thiele tutuari beroa eman, beheko aldetik, konbekzio korronte bat sortuz.Solidoa urtzen hastean T1 (ºC) apuntau eta guztiz urtzean T2 (ºC).Prozedura*3Saiakuntza bakoitzean (T1+T2)/2 kalkulatuBataz bestekoa, desbiderazioa eta RSD-a kalkulatu
t1 (ºC) / t2 (ºC) / (t2+t1):2 (ºC)
184 196 190
189 ± 1ºC , % 0.26
pH
HelburuaSolidoa azidoa edo base den jakitea pH-metroaren bidez, haren konposizioa kimikoa nolakoa den ezagutzeko.Oinarri TeorikoapH<7= Azidoa, pH=7 neutroa eta pH>7=BaseapH=-log(H+)Materiala ErreaktiboakpH-metroa Solidoa200 mL-ko hauspeakin ontzia Ur distilatuaHagatxoaEspatulaBalantzaErloju beiraProbetaArrainaImanaProzedura pH-metroa kalibratu, tresnak dituen instrukzioak agintzen dituen patroiak erabiliz.Disoluzioa prestatu 200mL-ko hauspeakin ontzian.100mL ur distilatua0.5 g solido problema50 mL-ko 2 disoluzioetan banatupH-a 4 aldiz neurtu, 2 aldiz disoluzio bakoitzari.Bataz bestekoa, desbiderazioa eta RSD-a kalkulatu.
2.8 ± 0.1 pH , %0.18
Eroankortasuna
HelburuaKorronte elektrikoa garraiatzeko gai den konprobatzea, modu honetan ioiak dituen ondorioztatuz.Oinarri teorikoaKonduktimetroaren bidez, bere unitatea mikroSiemens (mS) delarik.Materiala ErreaktiboakKonduktimetroa Ur distilatuaErloju beira Solido problemaProbeta Hauspeakin ontziaEspatulaBalantzaArrainaImanaProzeduraKonduktimetroa kalibratu, tresnak dituen instrukzioak agintzen dituen patroiak erabiliz.Disoluzioa prestatu 200mL-ko hauspeakin ontzian.100 mL ur distilatua0.5 g solido problema50 mL-ko 2 disoluzioetan banatu4 aldiz neurtu, 2 aldiz disoluzio bakoitzari.Bataz bestekoa, desbiderazioa eta RSD-a kalkulatu.
471±8 mS, %1.61
POLARRA
EZ ORGANIKOA
AZIDOA
EROALEA DA
ONDORIOAK
Aurreko konparaketan ikusten den moduan, gure solido problema aztertzerakoan lortu ditugun balioak eta Azido askorbikoaren erreferentziazko balioak bat egiten dute. Ondorio honetara iristeko, analisi lagungarriena eroankortasuna izan da, datu klabea izan baita. Izan ere, beste ezaugarri guztiekin aukera posibleak asko murriztu ditugu, baina eroankortasunak, esku artean zer substantzia genun determinatzen lagundu zigun. Hala ere, aipatu beharra dago lortutako balio batzuk ez daudela erreferentziazko balio horien barnean. Hain zuzen, analisiak burutzerakoan zenbait errore egin direlako, sistematikoak edota giza erroreak ere. Datu horien barnean ez egon arren, asko hurbiltzen dira eta Bitamina C dela ondorioztatzeko ezinbestekoak izan dira.