a Estefania Beltrán 1 éve
219
Enzimas: ¿Qué son y cómo funcionan?
a Estefania Beltrán 1 éve
219

Még több ilyen
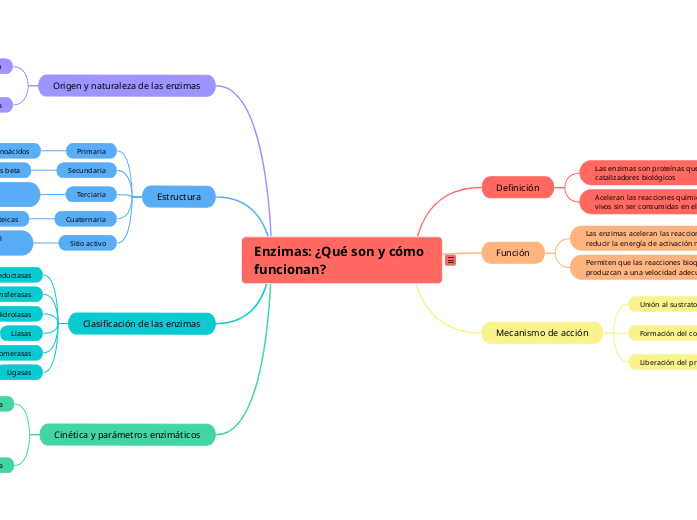
Enzimas: ¿Qué son y cómo funcionan? Definición: Las enzimas son proteínas que actúan como catalizadores biológicos, es decir, aceleran las reacciones químicas en los organismos vivos sin ser consumidas en el proceso. Función: Las enzimas aceleran las reacciones químicas al reducir la energía de activación necesaria para que la reacción ocurra. Esto permite que las reacciones bioquímicas se produzcan a una velocidad adecuada para la vida. Mecanismo de acción: Unión al sustrato: Las enzimas tienen una región específica llamada sitio activo, donde se une el sustrato (la molécula sobre la cual actúa la enzima). Formación del complejo enzima-sustrato: La unión del sustrato al sitio activo forma el complejo enzima-sustrato, lo que facilita la conversión del sustrato en producto. Liberación del producto: Una vez que la reacción ha ocurrido, los productos se liberan y la enzima queda libre para unirse a nuevas moléculas de sustrato. Origen y naturaleza de las enzimas Origen: Las enzimas son sintetizadas por las células vivas a través de la expresión génica. El ADN en el núcleo de las células contiene la información necesaria para la síntesis de enzimas específicas. Naturaleza química: Las enzimas son principalmente proteínas, aunque algunas moléculas de ARN también tienen actividad catalítica (ribozimas). Como proteínas, están compuestas por aminoácidos y tienen estructuras complejas. Estructura: Las enzimas presentan varios niveles de estructura: Primaria: Secuencia lineal de aminoácidos. Secundaria: Estructuras locales como hélices alfa y hojas beta. Terciaria: Plegamiento tridimensional de la cadena polipeptídica. Cuaternaria: Asociación de múltiples subunidades proteicas. Sitio activo: El sitio activo es una región específica de la enzima donde se une el sustrato. Es una cavidad o bolsillo formado por aminoácidos específicos que facilitan la unión y transformación del sustrato. Clasificación de las enzimas Las enzimas se clasifican en seis grandes clases según el tipo de reacción que catalizan: Oxidorreductasas: Catalizan reacciones de óxido-reducción, donde hay transferencia de electrones. Transferasas: Transfieren grupos funcionales de una molécula a otra. Hidrolasas: Rompen enlaces mediante la adición de agua. Liasas: Rompen enlaces sin la adición de agua ni oxidación. Isomerasas: Catalizan la reordenación de átomos dentro de una molécula. Ligasas: Forman enlaces covalentes entre dos moléculas con la utilización de ATP. Cinética y parámetros enzimáticos Cinética enzimática: Es el estudio de la velocidad de las reacciones catalizadas por enzimas y cómo esta velocidad cambia en respuesta a cambios en las condiciones experimentales. Factores que afectan la cinética enzimática Concentración de sustrato: Aumentar la concentración de sustrato generalmente aumenta la velocidad de reacción hasta que la enzima se satura. pH: Cada enzima tiene un pH óptimo en el cual su actividad es máxima. Desviarse de este pH puede disminuir la actividad enzimática. Temperatura: La velocidad de reacción enzimática aumenta con la temperatura hasta un punto óptimo, después del cual la enzima puede desnaturalizarse y perder actividad. Inhibidores: Competitivos: Compiten con el sustrato por el sitio activo de la enzima. No competitivos: Se unen a un sitio distinto del sitio activo, cambiando la conformación de la enzima y reduciendo su actividad. Acompetitivos: Se unen solo al complejo enzima-sustrato, impidiendo que la reacción proceda.
acompetitivos)
no competitivos